
| 选项 | 物质(括号内为杂质) | 实验方法 |
| A | K2SO4 (K2CO3) | 加入稀硫酸使溶液呈中性 |
| B | NaCl (KNO3) | 样品配制成热饱和溶液,冷却结晶,过滤 |
| C | CO2(HCl) | 通过NaHCO3饱和溶液,干燥 |
| D | 溴苯(溴) | 加入足量NaOH溶液,充分振荡,分液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.K2CO3与硫酸反应生成硫酸钾;
B.NaCl的量多,硝酸钾少,应蒸发结晶;
C.HCl与饱和碳酸氢钠溶液反应生成二氧化碳;
D.溴与NaOH反应后,与溴苯分层.
解答 解:A.K2CO3与硫酸反应生成硫酸钾,则加入稀硫酸使溶液呈中性可除杂,故A正确;
B.NaCl的量多,硝酸钾少,应蒸发结晶,不能冷却结晶分离,故B错误;
C.HCl与饱和碳酸氢钠溶液反应生成二氧化碳,则通过NaHCO3饱和溶液,干燥可除杂,故C正确;
D.溴与NaOH反应后,与溴苯分层,然后分液可分离,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| B. | 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向Na2CO3饱和溶液中,通入过量的CO2后,加热蒸干得NaHCO3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
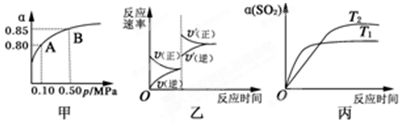
| A. | 由图甲推断,B点SO2的平衡浓度为0.3 mol•L-1 | |
| B. | 由图甲推断,A点对应温度下该反应的平衡常数为800(L•mol-1) | |
| C. | 达平衡后,若增大容器容积,则反应速率变化图象可以用图乙表示 | |
| D. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 1 | 543 | 催化剂A | 12.3 | 42.3 |
| 2 | 543 | 催化剂B | 10.9 | 72.7 |
| 3 | 553 | 催化剂A | 15.3 | 39.1 |
| 4 | 553 | 催化剂B | 12.0 | 71.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.01mol•L-1的醋酸溶液中,pC(H+)=2 | |
| B. | 常温下,向0.01mol•L-1的氨水中加入等体积等浓度的盐酸,混合液的pC(H+)<7 | |
| C. | 100℃时,0.01mol•L-1的NaOH溶液中,pC(OH-)+pC(H+)=14 | |
| D. | 100℃时,CaCO3的Ksp=2.5×10-9,其饱和溶液中pC(Ca2+)+pC(CO32-)=9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com