
| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①③ |
分析 ①氯气和氢气的化合为放热反应并且焓变与系数成正比;
②H2O分解为吸热,Na与H2O反应为放热;
③液态乙醇转化为气态乙醇的过程是吸收热量的;
④因为1molN2和3molH2反应生成氨气为气体体积减小的反应,所以恒容相对于在恒压的基础上增大体积即减小压强,平衡逆向移动,据此分析.
解答 解:①氯气和氢气的化合为放热反应,所以焓变为负值,又焓变与系数成正比,所以H2(g)+Cl2(g)=2HCl(g)△H1;$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2;△H1<△H2,故错误;
②H2O分解为吸热,则2H2O(l)=2H2(g)+O2(g)△H1>0;Na与H2O反应为放热,则2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H2<0;所以△H1>△H2,故正确;
③液态乙醇转化为气态乙醇的过程是吸收热量的,所以气态乙醇燃烧放热多,则△H1<△H2,故正确;
④因为1molN2和3molH2反应生成氨气为气体体积减小的反应,所以恒容相对于在恒压的基础上增大体积即减小压强,平衡逆向移动,则放出热量减小,所以Q1<Q2,故正确;
故选C.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.


科目:高中化学 来源: 题型:解答题
 二氧化硫在生产和生活中有重要的应用.
二氧化硫在生产和生活中有重要的应用. S+2CO2.
S+2CO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 实验方法 |
| A | K2SO4 (K2CO3) | 加入稀硫酸使溶液呈中性 |
| B | NaCl (KNO3) | 样品配制成热饱和溶液,冷却结晶,过滤 |
| C | CO2(HCl) | 通过NaHCO3饱和溶液,干燥 |
| D | 溴苯(溴) | 加入足量NaOH溶液,充分振荡,分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量盐酸观察是否有气体产生 | |
| B. | 加热观察是否有气体产生 | |
| C. | 加入过量盐酸观察是否有气体产生 | |
| D. | 加入少量碳酸氢钙溶液观察是否有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、NO3-、Cl- | B. | K+、Na+、Br-、Cl- | ||
| C. | K+、NH4+、HCO3-、Cl- | D. | Na+、Mg2+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 4:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
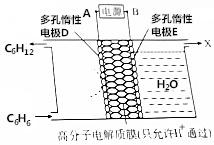 利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )| A. | A极为电源的正极 | |
| B. | 储氢反应的电极反应式为:C6H6+6H++6e-═C6H12 | |
| C. | 右室得到的气体X为O2 | |
| D. | 该储氢和储能的反应为2C6H6+6H2O$\frac{\underline{\;通电\;}}{\;}$2C6H12+3O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n>p | B. | m+n<p | ||
| C. | 平衡向正反应方向移动 | D. | C的质量分数增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com