
【题目】O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A. 氧气是氧化产物 B. O2F2既是氧化剂又是还原剂
C. 若生成4.48 L HF,则转移0.8 mol电子 D. 还原剂与氧化剂的物质的量之比为1:4
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。
Ⅰ. CO还原法
(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如右图I所示,每生成16gS(s) ,该反应_______(填“放出”或“吸收”)的热量为_________。

(2)在绝热恒容的密闭容器中,进行反应:
2CO(g)+SO2(g) ![]() S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
A.若混合气体密度保持不变,则已达平衡状态
B.反应开始到平衡时,容器内气体的压强保持不变
C.达平衡后若再充人一定量CO2,平衡常数保持不变
D.分离出S,正、逆反应速率均保持不变
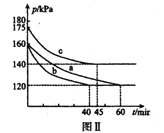
(3)向2L恒温恒容密闭容器中通入2molCO和lmolSO2,分别进行a、b、c三组实验。在不同条件下发生反应:2CO(g)+SO2(g)![]() S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
Ⅱ.Na2SO3溶液吸收法
常温下,用300mL1.0mol·L-1,Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如上图Ⅲ所示。
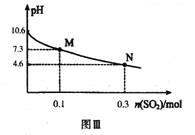
(4)1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________
(5)若用等体积、等物质的量浓度的下列溶液分别吸收SO2,则理论上吸收量最多的是____
A. NH3·H2O B. Na2S C. Na2CO3 D. FeCl3
(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年12月6日,上海遭遇重度雾霾,空气质量指数达六级重度污染。雾霾是雾和霾的混合物,其中雾是自然天气现象,霾的核心物质是悬浮在空气中的烟、灰尘等物质,其中霾属于悬浊液,雾所属的分散系是( )
A. 溶液 B. 悬浊液 C. 乳浊液 D. 胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
硫酸
分子式:H2SO4
相对分子质量:98
密度:1.84g/mL
H2SO4的质量分数:98%
(1)该浓硫酸中H2SO4的物质的量浓度为_________。
(2)某学生欲用上述浓硫酸和蒸馏水配制100mL物质的量浓度为0.8 mol·L-1的稀硫酸,该学生需要量取_________mL上述浓硫酸进行配制。
(3)为配制(2)中的稀硫酸,除了量筒、烧杯、胶头滴管外,还缺少的玻璃仪器是_________。
(4)在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是_________(填序号)。
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.容量瓶未干燥即用来配制溶液
e.往容量瓶转移时,有少量液体溅出;
f.未洗涤稀释浓硫酸的烧杯;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子在指定的分散系中能大量共存的一组是( )
A.空气:HCl、CO2、SO2、NO
B.烧碱溶液:K+、HCO![]() 、NO
、NO![]() 、NH3·H2O
、NH3·H2O
C.高锰酸钾溶液:H+、Na+、SO![]() 、CH3COOH
、CH3COOH
D.氢氧化铁胶体:H+、K+、S2-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,有物质①4gH2,②33.6LCH4, ③1molH2O,④3.01×1023个O2,含分子数最多的是(填序号,下同)______________,质量最大的是______,体积最小的________,密度由大到小的顺序为:________________________。
(2)在无土栽培中,配制1 L内含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为________、_________ 、_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是( )
A. K、Na、Li B. N、O、C C. Cl、S、P D. Al、Mg、Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶 F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度之比为1:2.则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
A.1:1 B.1:2 C.1:3 D.2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com