
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A. 原子半径A>B>D>C B. a+2=b+1=c-3=d-1
C. 单质的还原性A>B>D>C D. 离子半径C>D>B>A
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素同周期,且从左到右按原子序数的递增(原子序数为五个连续的自然数)的顺序排列如下:
![]()
下列说法正确的是
A. 若HnCOm为强酸,则D元素肯定是活泼的非金属元素
B. 若A(OH)n为强碱,则B(OH)m也一定为强碱
C. 若C的最高正化合价为+5价,则五种元素均为非金属元素
D. 若D的最低负化合价为-2价,则E的最高正价为+6价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学对有关物质的分类进行讨论辨析:①生铁、氯水都属于混合物 ②AlCl3溶液、蛋白质溶液都属于溶液 ③CO2、CO都属于酸性氧化物 ④含氢原子的盐不一定属于酸式盐。上述说法中正确的是( )
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。 下列叙述错误的是
A.疫苗因未冷藏储运而失效,与蛋白质变性有关
B.天然气既是高效清洁的化石燃料,又是重要的化工原料
C.“中国天眼”的镜片材料为SiC,属于新型有机非金属材料
D.港珠澳大桥水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把与下列元素有关性质相符的曲线标号填入相应空格中:
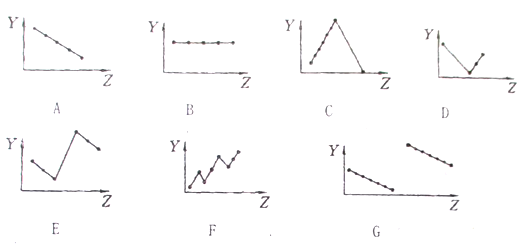
(1)第IIA族元素的价电子数_________;
(2)第三周期元素的最高化合价有_______ ;
(3)碱金属单质熔点_______ ;
(4)第三周期离子Na+、Mg2+、A13+、P3-、S2-、Cl-的离子半径_______ ;
(5)第二、三周期元素随原子序数递增原子半径的变化_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种元素,A2﹣和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
(1)四种元素中电负性最大的是(填元素符号),其中C原子的核外电子排布式为 .
(2)单质A有两种同素异形体,其中沸点高的是(填分子式),原因是;A和B的氢化物所属的晶体类型分别为和 .
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为 , 中心原子的杂化轨道类型 .
(4)化合物D2A的立体构型为 , 中心原子的价层电子对数为 , 单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 .
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为 , 晶胞中A原子的配位数为;列式计算晶体F的密度(gcm﹣3).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们可以用水解度来表示盐水解程度的大小,它是用已水解的物质的量占原来总的电解质物质的量的分数来表示的.若测得2L 0.1mol/L的强碱弱酸盐NaA溶液的常温下的pH为10,则A﹣的水解度为( )
A.0.01%
B.0.1%
C.0.2%
D.1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2 . 下表是25℃时HClO2 及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | HCN | H2S |
Ka | 1×10﹣2 | 6.3×10﹣4 | 4.9×10﹣10 | K1=9.1×10﹣8K2=1.1×10﹣12 |
(1)常温下,物质的量浓度相等的①NaClO2、②NaF、③NaCN、④Na2S四种溶液的pH由大到小的顺序为;体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”).
(2)Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+ 离子,滴加Na2S溶液后首先析出的沉淀是;当最后一种离子沉淀完全时(该离子浓度为10﹣5molL﹣1)此时的S2﹣的浓度为 .
已知Ksp(FeS)=6.3×10﹣18(molL﹣1)2 , Ksp(CuS)=6×10﹣36(molL﹣1)2 , Ksp(PbS)=2.4×10﹣28(molL﹣1)2 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com