
【题目】A、B、C、D为原子序数依次增大的四种元素,A2﹣和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
(1)四种元素中电负性最大的是(填元素符号),其中C原子的核外电子排布式为 .
(2)单质A有两种同素异形体,其中沸点高的是(填分子式),原因是;A和B的氢化物所属的晶体类型分别为和 .
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为 , 中心原子的杂化轨道类型 .
(4)化合物D2A的立体构型为 , 中心原子的价层电子对数为 , 单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 .
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为 , 晶胞中A原子的配位数为;列式计算晶体F的密度(gcm﹣3).
【答案】
(1)O;1s22s22p63s23p3
(2)O3;O3相对分子质量较大,范德华力较大;分子晶体;离子晶体
(3)三角锥形;sp3
(4)V形;4;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaC
(5)Na2O;8;2.27
【解析】解:C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2﹣和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素,(1)四种元素分别为O、Na、O、Cl,电负性最大的为O元素,C为P元素,核外电子排布为1s22s22p63s23p3 , 所以答案是:O;1s22s22p63s23p3;(2)A为O元素,有O2、O3两种同素异形体,二者对应的晶体都为分子晶体,因O3相对分子质量较大,则范德华力较大,沸点较高,A的氢化物为水,为分子晶体,B的氢化物为NaH,为离子晶体,所以答案是:O3;O3相对分子质量较大,范德华力较大;分子晶体;离子晶体;(3)C和D反应可生成组成比为1:3的化合物为PCl3 , P形成3个δ键,孤电子对数为 ![]() =1,则为sp3杂化,立体构型为为三角锥形,所以答案是:三角锥形;sp3;(4)化合物D2A为Cl2O,O为中心原子,形成2个δ键,孤电子对数为
=1,则为sp3杂化,立体构型为为三角锥形,所以答案是:三角锥形;sp3;(4)化合物D2A为Cl2O,O为中心原子,形成2个δ键,孤电子对数为 ![]() =2,则中心原子的价层电子对数为4,立体构型为V形,氯气与湿润的Na2CO3反应可制备Cl2O,反应的方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,所以答案是:V形;4;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;(5)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的顶点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×
=2,则中心原子的价层电子对数为4,立体构型为V形,氯气与湿润的Na2CO3反应可制备Cl2O,反应的方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,所以答案是:V形;4;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;(5)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的顶点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8× ![]() +6×
+6× ![]() =4, N(Na):N(O)=2:1,则形成的化合物为Na2O,晶胞中O位于顶点,Na位于体心,每个晶胞中有1个Na与O的距离最近,每个定点为8个晶胞共有,则晶胞中O原子的配位数为8,晶胞的质量为
=4, N(Na):N(O)=2:1,则形成的化合物为Na2O,晶胞中O位于顶点,Na位于体心,每个晶胞中有1个Na与O的距离最近,每个定点为8个晶胞共有,则晶胞中O原子的配位数为8,晶胞的质量为 ![]() ,晶胞的体积为(0.566×10﹣7)cm3 , 则晶体F的密度为
,晶胞的体积为(0.566×10﹣7)cm3 , 则晶体F的密度为 ![]() =2.27gcm﹣3 , 所以答案是:Na2O;8;2.27gcm﹣3 .
=2.27gcm﹣3 , 所以答案是:Na2O;8;2.27gcm﹣3 .


科目:高中化学 来源: 题型:
【题目】A、B、C、D.E是短周期元素,周期表中A与B、C与E相邻;A与E的最外层电子数之比2:3,B的最外层电子数比C的最外层电子数少1个;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红。
(1)E的元素名称是_______,该己素在周期表中的位置为_______。
(2)A、B、C的氢化物稳定性又弱到强的顺序为(用分子式表示)_______;B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中所含化学键的类型为________。
(3)写出D2C2的电子式________。用电子式表示只含D、E两种元素的化合物的形成过程________。
(4)写出D2C2与H2O反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应有关的是( )
A.氨气遇到HCl气体后产生白烟
B.品红溶液通入SO2气体后褪色
C.湿润的淀粉碘化钾试纸遇Cl2变蓝
D.在无色火焰上灼烧NaCl火焰呈黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A. 原子半径A>B>D>C B. a+2=b+1=c-3=d-1
C. 单质的还原性A>B>D>C D. 离子半径C>D>B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M、R、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | |
原子半径 | 0.186 | 0.074 | 0.099 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其他 | 阳离子无核外电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)X和M的原子可构成18电子的分子,该分子的结构式为_______ .
(2)Z与Q相比,金属性较强的是_______ (用元素符号表示),下列事实能证明一结论的是_______ (填字母序号)。
a.Q的熔点比Z的熔点高,Q的硬度比Z的硬度大
b.Z与冷水反应迅速,而Q与冷水几乎不反应
c.Z的最高价氧化物对应水化物是强碱,而Q的最高价氧化物对应水化物具有两性
(3)与Y元素同主族的短周期元素E在自然界中存在多种核素,它们之间的关系互为_______,其中用于测定一些文物年代的核素的符号为_______ 。
(4)写出Z2M2的电子式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
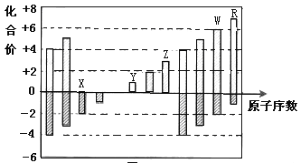
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:W>R
C. W最高价氧化物对应的水化物是强碱
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质的合成或制备是有机化学、无机化学的重要任务之一.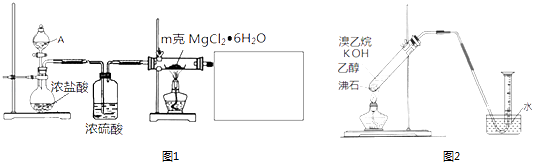
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了图1装置①分液漏斗中的A物质是(填试剂名称).
②利用中学常见的仪器,空白方框内补充完整实验装置 .
可选择的试剂有:A.稀NaOH溶液 B.无水氯化钙 C.稀硫酸 D.浓硫酸
③假设实验过程中 MgCl26H2O 未水解,不用任何试剂用最简单的方法检验MgCl26H2O 是否完全转化为MgCl2 . 写出实验方法 .
(2)实验室制备并收集纯净乙烯①有的同学通过乙醇制备乙烯,写出相关化学方程式: .
该实验除乙醇外,所需的试剂或用品(不包括仪器)有、、 .
②有的同学探究其它制备乙烯的方法,他设计了图2装置制备乙烯.实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体.
请分析气体产率很低的原因主要是 .
为增大气体产率,在右图装置的基础上,提出一点改进措施: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图A~K都是中学化学实验中使用的或能够制备的物质,已知A~K物质中部分是某二价金属元素X的化合物,有一些是含常见非金属元素Y的物质,且C、E、G、K是气体,物质间有如下反应关系: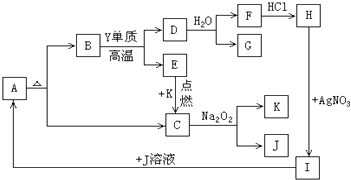
请填写:
(1)元素X的符号 , 元素Y的名称 .
(2)写出反应D→G+F的化学方程式 .
(3)写出反应C→K+J的化学方程式 .
(4)除I外,还有(填字母)能与J溶液反应生成A.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com