
����Ŀ���о����ʵĺϳɻ��Ʊ����л���ѧ������ѧ����Ҫ����֮һ��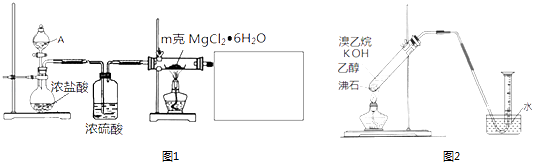
��1��ijʵ��С��̽��ʵ�����Ʊ���ˮ�Ȼ�þ�ķ����������ͼ1װ�âٷ�Һ©���е�A�����������Լ����ƣ���
��������ѧ�������������հ����ڲ�������ʵ��װ�� ��
��ѡ����Լ��У�A��ϡNaOH��Һ B����ˮ�Ȼ��� C��ϡ���� D��Ũ����
�ۼ���ʵ������� MgCl26H2O δˮ�⣬�����κ��Լ�����ķ�������MgCl26H2O �Ƿ���ȫת��ΪMgCl2 �� д��ʵ�鷽�� ��
��2��ʵ�����Ʊ����ռ�������ϩ���е�ͬѧͨ���Ҵ��Ʊ���ϩ��д����ػ�ѧ����ʽ�� ��
��ʵ����Ҵ��⣬������Լ�����Ʒ�������������������� ��
���е�ͬѧ̽�������Ʊ���ϩ�ķ������������ͼ2װ���Ʊ���ϩ��ʵ��������Ͳ�ڱڸ��Ž϶���ɫ��״Һ�壬�ҵõ������������壮
�����������ʺܵ͵�ԭ����Ҫ�� ��
Ϊ����������ʣ�����ͼװ�õĻ����ϣ����һ��Ľ���ʩ�� ��
���𰸡�
��1��Ũ���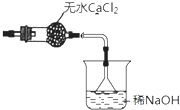 ���������ò���������������Ϊ
���������ò���������������Ϊ ![]() g��˵��MgCl2?6H2O��ȫת��ΪMgCl2 �� ����δ��ȫ
g��˵��MgCl2?6H2O��ȫת��ΪMgCl2 �� ����δ��ȫ
��2��CH3CH2OH ![]() CH2=CH2��+H2O��Ũ�������������Һ����ʯ�������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�������������װ�õ�
CH2=CH2��+H2O��Ũ�������������Һ����ʯ�������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�������������װ�õ�
���������⣺��1�������Ȼ�þ����ʧȥ�ᾧˮ�õ���ˮ�Ȼ�þ�������Ȼ�þ��ˮ�⣬Ӧ��HCl��Χ�м��ȷֽ⣬A��Һ��ΪŨ���ᣬ��Բ����ƿ��Ũ�����ϣ������������ȣ�����HCl�ݳ���ϴ��ƿ��Ũ�������HCl����������������Һ����β����HCl����ֹ��Ⱦ������ע���ֹ��������Ҫ��ֹ����������Һ��ˮ���������Ȼ�þˮ�⣬β������װ�������װ��֮����Ҫ����ʢ���Ȼ��Ƶĸ���ܣ���ʢ��Ũ�����ϴ��ƿ������������������֪����Һ©���е�A������Ũ���ᣬ���Դ��ǣ�Ũ�������������������Һ����β����HCl����ֹ��Ⱦ�������ҷ�ֹ��������Ҫ��β������װ�������װ��֮����Ҫ����ʢ���Ȼ��Ƶĸ���ܣ���ʢ��Ũ�����ϴ��ƿ������ֹ�Ȼ�þˮ�⣬��Ҫ��������ʵ��װ��Ϊ��  �ȣ� ���Դ��ǣ�
�ȣ� ���Դ��ǣ�  �ȣ���ʵ�������MgCl26H2Oδˮ�⣬mg��������ʵ���Ϊ
�ȣ���ʵ�������MgCl26H2Oδˮ�⣬mg��������ʵ���Ϊ ![]() mol����ȫ�ֽ�õ��Ȼ�þΪ
mol����ȫ�ֽ�õ��Ȼ�þΪ ![]() mol��95g/mol=
mol��95g/mol= ![]() g���������ò���������������Ϊ
g���������ò���������������Ϊ ![]() g��˵��MgCl26H2O��ȫת��ΪMgCl2 �� ����δ��ȫ�����Դ��ǣ��������ò���������������Ϊ
g��˵��MgCl26H2O��ȫת��ΪMgCl2 �� ����δ��ȫ�����Դ��ǣ��������ò���������������Ϊ ![]() g��˵��MgCl26H2O��ȫת��ΪMgCl2 �� ����δ��ȫ����2�����Ҵ���Ũ���������·�����ȥ��Ӧ������ϩ����Ӧ����ʽΪ��CH3CH2OH
g��˵��MgCl26H2O��ȫת��ΪMgCl2 �� ����δ��ȫ����2�����Ҵ���Ũ���������·�����ȥ��Ӧ������ϩ����Ӧ����ʽΪ��CH3CH2OH ![]() CH2=CH2��+H2O����Ӧ�лᷢ������Ӧ���ж�����̼�������������ɣ�������������Һ���ճ�ȥ������̼����������Һ�������Ҫ��ֹ���У�����Ҫ�����ʯ�����Ҵ��⣬������Լ�����Ʒ���������������У�Ũ���ᡢ����������Һ����ʯ�����Դ��ǣ�CH3CH2OH
CH2=CH2��+H2O����Ӧ�лᷢ������Ӧ���ж�����̼�������������ɣ�������������Һ���ճ�ȥ������̼����������Һ�������Ҫ��ֹ���У�����Ҫ�����ʯ�����Ҵ��⣬������Լ�����Ʒ���������������У�Ũ���ᡢ����������Һ����ʯ�����Դ��ǣ�CH3CH2OH ![]() CH2=CH2��+H2O��Ũ���ᡢ����������Һ����ʯ���ڷ��������������鷢����ȥ��Ӧ������ϩ������ͼ��װ���Ʊ���ϩ��ʵ��������Ͳ�ڱڸ��Ž϶���ɫ��״Һ�壬�ҵõ������������壬˵��������ϩ���٣�������������ӷ���������ʺܵ͵�ԭ����Ҫ�ǣ������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�Ϊ����������ʣ�����������������װ�ã�������������������������������ˮԡ���ȣ����ڿ����¶ȵȣ�����������ӷ������Դ��ǣ������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�������������װ�õȣ�
CH2=CH2��+H2O��Ũ���ᡢ����������Һ����ʯ���ڷ��������������鷢����ȥ��Ӧ������ϩ������ͼ��װ���Ʊ���ϩ��ʵ��������Ͳ�ڱڸ��Ž϶���ɫ��״Һ�壬�ҵõ������������壬˵��������ϩ���٣�������������ӷ���������ʺܵ͵�ԭ����Ҫ�ǣ������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�Ϊ����������ʣ�����������������װ�ã�������������������������������ˮԡ���ȣ����ڿ����¶ȵȣ�����������ӷ������Դ��ǣ������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�������������װ�õȣ�


 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�������ͺ�ˮ��Һ����39%���Ҵ���Һ�����Ȼ��ƺ͵������ˮ��Һ���������ϸ����Һ����ȷ���������ǣ� ��
A. ��Һ��������ȡB. ��ȡ����������Һ
C. ��Һ����ȡ������D. ������ȡ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��DΪԭ�������������������Ԫ�أ�A2����B+������ͬ�ĵ��ӹ��ͣ�C��DΪͬ����Ԫ����C�������������������������3����DԪ���������һ��δ�ɶԵ��ӣ��ش��������⣺
��1������Ԫ���е縺������������Ԫ�ط��ţ�������Cԭ�ӵĺ�������Ų�ʽΪ ��
��2������A������ͬ�������壬���зе�ߵ����������ʽ����ԭ������A��B���⻯�������ľ������ͷֱ�Ϊ�� ��
��3��C��D��Ӧ��������ɱ�Ϊ1��3�Ļ�����E��E�����幹��Ϊ �� ����ԭ�ӵ��ӻ�������� ��
��4��������D2A�����幹��Ϊ �� ����ԭ�ӵļ۲���Ӷ���Ϊ �� ����D��ʪ���Na2CO3��Ӧ���Ʊ�D2A���仯ѧ����ʽΪ ��
��5��A��B�ܹ��γɻ�����F���侧���ṹ��ͼ��ʾ����������a=0.566nm��F�Ļ�ѧʽΪ �� ������Aԭ�ӵ���λ��Ϊ����ʽ���㾧��F���ܶ���gcm��3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��8g NaOH��������ˮ���1000 mL��Һ��ȡ�����е�10 mL����10 mL NaOH��Һ�����ʵ���Ũ��Ϊ �� ��
A. 1 molL-1 B. 0.5 molL-1 C. 0.25 molL-1 D. 0.2 molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǿ�����ˮ�������ʾ��ˮ��̶ȵĴ�С����������ˮ������ʵ���ռԭ���ܵĵ�������ʵ����ķ�������ʾ�ģ������2L 0.1mol/L��ǿ��������NaA��Һ�ij����µ�pHΪ10����A����ˮ���Ϊ�� ��
A.0.01%
B.0.1%
C.0.2%
D.1%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£�2�������A2��1�������B2��ȫ��Ӧ������2�������X����X�Ļ�ѧʽ�ǣ� ��
A. A2BB. A2B2C. AB2D. AB3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���������ѧ��Ӧ�������仯����H���뷴Ӧ���������ļ����йأ����ܿ��Լ�����Ϊ�Ͽ�1mol��ѧ��ʱ�������յ��������±��Dz��ֻ�ѧ���ļ������ݣ�
��ѧ�� | P��P | P��O | O=O | P=O |
����/kJmol��1 | 197 | 360 | 499 | X |
��֪����ȼ����Ϊ2378.0kJ/mol��������ȫȼ�յIJ���ṹ��ͼ��ʾ�����ϱ���X=kJmol��1 �� �� ��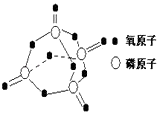
A.1057.5 kJmol��1
B.335.25 kJmol��1
C.433.75 kJmol��1
D.959.0 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�����������������ʵ�ֵ��� (�� ��)
A. H2S��SO2 B. Fe2����Fe C. CO32����CO2 D. 2H����H2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com