
【题目】【化学—选修3:物质结构与性质】
硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态铁原子的外围电子排布式为___________;Fe3+比Fe2+稳定的原因是___________。
(2)第二周期中,元素的第一电离能处于B与N之间的元素有___________种。
(3)NF3是微电子工业中优良的等离子刻蚀气体,NF3分子的空间构型为___________;在NF3中,N原子的杂化轨道类型为___________。
(4)与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___________,层间作用力为___________。
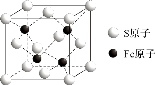
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为___________。假设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)___________cm。
【答案】(1)3d64s2;Fe3+的价电子排布为3d5,d轨道处于半充满状态,属于稳定结构;(2)3;(3)三角锥形;sp3;(4)共价键(或极性共价键);范德华力(或分子间作用力);⑸FeS;![]() 。
。
【解析】
试题分析:(1)外围电子指价电子,过渡元素的价电子包括最外层和次外层的d能级上的电子,铁属于26号元素,属于第四周期VIII族元素,因此外围电子排布式为3d64s2;Fe3+的价电子排布式为3d5,Fe2+价电子排布式为3d6,根据洪特规则,处于半满、全满、全空,处于稳定结构,因此原因是:Fe3+的价电子排布为3d5,d轨道处于半充满状态,属于稳定结构;(2)同周期从左向右第一电离能逐渐增大,但IIA>IIIA,VA>VIA,因此在B和N之间有Be、C、O三种;(3)NF3中N有3个σ键,孤电子对数(5-3×1)/2=1,价层电子对数为4,杂化轨道数=价层电子对数,即NF3中N的杂化类型是sp3,空间构型为三角锥形;(4)石墨中层内C和C之间以共价键结合,石墨层层之间以分子间作用力结合,B和N为非金属,B和N之间的化学键为共价键,层间作用力是分子间作用力;(5)根据均摊方法,S原子位于顶点和面上,晶胞中S的个数是8×1/8+6×1/2=4,Fe位于晶胞体内,因此化学式为FeS,设晶胞的边长为a,晶胞的质量为4×88/NAg,晶胞的体积为a3cm3,根据密度的定义,a=![]() ,距离最近的S原子之间的距离是面对角线的一半,即
,距离最近的S原子之间的距离是面对角线的一半,即![]() 。
。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)请配平以下化学方程式:
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
若反应过程中转移5 mol电子,则生成标准状况下N2的体积为___________L。
(2)25℃时,将a mol·L-1的氨水与0.1mol·L-1的盐酸等体积混合,当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为_____________。
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式_______________。
(4)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
HSO3-的电离平衡常数表达式K=_________。
0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________。
H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是两种常见短周期元素的单质,有关物质的转化关系如图所示。下列有关说法,错误的是( )
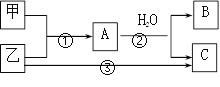
A. 若C为酸性气体,则B可能具有两性
B. 若C是碱性气体,则B一定是碱
C. 若B、C是两种酸,则B、C一定都是一元酸
D. 以上3个转变可能都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列处理方法中,正确的是
A. 做实验剩余的金属钠直接丢弃在废液缸中
B. 将过期的化学药品直接倒入下水道
C. 稀释浓硫酸时,将浓硫酸沿器壁缓慢注入水中并不断搅拌
D. 大量氯气泄漏时,迅速离开现场并尽量往低处去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有分别含有A、B、C、D、E、F的六瓶无色溶液(中学常用的无机试剂)。已知纯E为无色油状液体,溶于水时会放出大量热;B、C、D和F是常见金属的盐,且它们的阴离子均不同。现进行如下实验:
①A的溶质为有刺激性气味的气体,其水溶液用沾有浓盐酸的玻璃棒接近时产生白色烟雾;
②将A的溶液分别加入其它五种物质的溶液中,只有溶有D、F的溶液中有白色沉淀产生;继续加入过量A溶液时,D中沉淀无变化,F中沉淀完全溶解;
③将B的溶液分别加入C、D、E、F的溶液中,含C、D、F的三种溶液中均产生沉淀,D、E溶液中有无色、无味气体逸出;
④将C的溶液分别加入D、E、F中,均有白色沉淀生成,再加入稀HNO3,沉淀均不溶.其中一种沉淀X在医疗上有非常重要的用途,其密度很大,且能够阻止X射线通过。
根据上述实验信息,请回答下列问题:
(1)溶质C对水的电离平衡是 (填“促进”、“抑制”或“无影响”,下同), 溶质D对水的电离平衡是 (填“促进”、“抑制”或“无影响”)。
(2)确定溶液B中的阳离子通过 (填方法)鉴定。
(3)写出上述六种溶液能采用两溶液互滴法就可鉴别的所有溶液组 。
(4)将等体积、等物质的量浓度的A溶液和E溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 。
(5)已知常温下X的溶解度为2.33×10-4g,则Ksp(X)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设一个蛋白质分子由两条肽链共500个氨基酸分子组成,则此蛋白质分子中-COOH数目至少为
A. 502个 B. 500个 C. 2个 D. 1个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com