
 键与
键与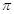 键数目之比为 。
键数目之比为 。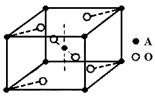
 键,而三键是由1个
键,而三键是由1个 键与2个
键与2个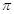 键构成的,所以HCN分子中
键构成的,所以HCN分子中 键与
键与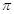 键数目之比为1:1。
键数目之比为1:1。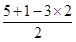 =0,因此价层电子对数是3,所以空间构型是平面三角形。
=0,因此价层电子对数是3,所以空间构型是平面三角形。 =2,O原子数=2+4×
=2,O原子数=2+4×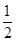 =4,所以该氧化物的化学式为AO2。
=4,所以该氧化物的化学式为AO2。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
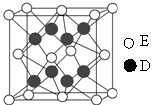
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
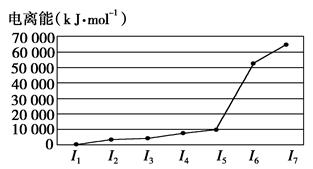
| | X—Y | X=Y | X≡Y |
| BD的键能/kJ·mol-1 | 357.7 | 798.9 | 1 071.9 |
| C2的键能/kJ·mol-1 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
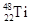 和
和 两种原子,它们互称为 ,钛基态原子的电子排布式为 ;
两种原子,它们互称为 ,钛基态原子的电子排布式为 ;
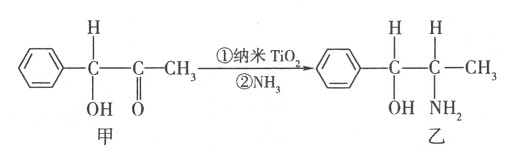
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.14N与15N为同种核素 |
| B.14N的第一电离能小于14C |
| C.15NH3与14NH3均能形成分子间氢键 |
| D.CH315NH2与CH3CH214NH2互为同系物 |
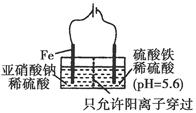
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.分子中含有氢键 |
| B.属于非极性分子 |
| C.含有4个σ键和1个π键 |
| D.该氢化物分子中,②原子采用sp2杂化 |
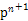 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。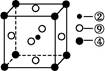
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com