
| A. |  表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 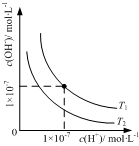 表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1 | |
| C. | 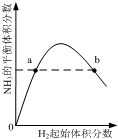 表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 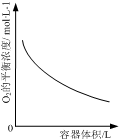 表示同一温度下,在不同容积的容器中进行反应2NO2(g)?2NO(g)+O2(g),O2的平衡浓度与容器容积的关系 |
分析 A.醋酸是弱酸溶液中存在电离平衡,加水稀释平衡正向进行,如稀释10n倍,溶液PH增大数值小于n;
B.水的电离过程是吸热过程,加热促进电离平衡正向进行;一定温度下存在离子积常数;
C.两种反应物增加一种会提高另一种物质的转化率;
D.体积越大压强越小,平衡向气体体积增大的分析进行.
解答 解:A.醋酸是弱酸溶液中存在电离平衡,加水稀释平衡正向进行,如稀释10n倍,溶液PH增大数值小于n,图象中是体积增大10n,溶液PH增大n个单位,不能表示出电离平衡正向进行的变化,图想错误,故A选;
B.水的电离过程是吸热过程,加热促进电离平衡正向进行,氢离子浓度增大,氢氧根离子浓度减小,一定温度下存在离子积常数,温度越高氢离子和氢氧根离子浓度越大,T2<T1,图象变化符合离子浓度变化,故B不选;
C.两种反应物增加一种会提高另一种物质的转化率,随氢气体积分数增大,氮气转化率增大,所以图中a点N2的转化率小于b点,图象变化符合转化率变化,故C不选;
D.2NO2(g)?2NO(g)+O2(g),反应是气体体积增大的反应,体积越大压强越小,平衡向气体体积增大的分析进行,正向进行,但体积增大对浓度影响大,所以氧气平衡浓度减小,图象变化符合反应变化,故D不选;
故选A.
点评 本题考查了弱电解质电离平衡、化学平衡影响因素的分析判断,溶液稀释平衡状态下离子浓度减小,注意体积变化和平衡移动的关系判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; +HBr→
+HBr→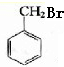 +H2O、
+H2O、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中,加入1.5mol H2和0.5mol N 2充分反应后,可得到NH3分子数为NA | |
| B. | 25℃时,1L pH=1的稀硫酸溶液中含有的H+数目为0.1NA | |
| C. | 1 mol•L-1的NaClO溶液中所含ClO-的数目为NA | |
| D. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2溶液 | B. | AgNO3溶液 | C. | H2SO4溶液 | D. | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.00 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1的NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com