
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态Ga原子价电子排布式__________________,核外电子占据最高能级的电子云形状为_________;基态As原子最高能层上有_______个电子。
(2)镓失去电子的逐级电离能(单位:kJmol1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的第一电离能比镓_____(填“大”或“小”)。
(3)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为__________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中Ga原子的杂化方式为______,AsH3分子的空间构型为____________。
(5)相同压强下,AsH3的沸点______NH3(填“大于”或“小于”),原因为__________________
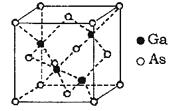
(6)GaAs为原子晶体,其晶胞结构如图所示,Ga与As以___________(填“共价键”或“离子键”)键合。设阿伏伽德罗常数的值为NA,该晶胞边长为a pm,则GaAs晶体的密度为_____gcm3(列出计算式即可)。
【答案】4s24p1 哑铃形(或纺锤形) 5 +1 大 V、Co sp2 三角锥形 小于 NH3与AsH3的结构相似,NH3分子间能形成氢键,沸点更高 共价键 ![]()
【解析】
(1) Ga位于周期表中第4周期第ⅢA族,As位于周期表中第4周期第ⅤA族;
(2)根据电离能差值分析元素的化合价,电离能差值过大说明失去该电子较困难,同周期元素随着原子序数增大,电负性增强,同主族元素随着原子序数增大,电负性减小;
(3)基态As原子核外1s22s22p63d104s24p3或[Ar]3d104s24p3,核外未成对电子数目为3;
(4)利用价层电子对互斥模型判断原子杂化方式;As与N同主族位于第VA族其氢化物的结构与氨气相同;
(5) NH3分子间能形成氢键;
(6)GaAs为原子晶体,原子间以共价键结合;利用均摊法计算一个晶胞中含有的As、Ga原子数,通过计算晶胞体积、晶胞中As、Ga的总质量就可计算出密度。
(1)Ga为31号元素,核外有31个电子,基态镓(Ga)原子的电子排布式为1s22s22p63s23p63d104s24p1,核外电子占据最高能级为4p,电子云形状为哑铃形;As元素的基态原子核外电子排布式1s22s22p63d104s24p3,最高能层上有5个电子;
(2)根据Ga失去电子的逐级电离能数值,第一电离能和第二电离能差值较大,且第三电离能和第四电离能数值差别较大,说明失去第二个电子和失去第四个电子较困难,所以呈现的价态是+1和+3;Ga、As是同一周期的元素,一般情况下,同一周期的元素,原子序数越大,元素的非金属性越强,其电负性越大,所以电负性As>Ga;
(3)基态As原子核外1s22s22p63d104s24p3或[Ar]3d104s24p3,核外未成对电子数目为3,第四周期元素中,基态V原子核外电子排布式为1s22s22p63s23p63d34s2,基态Co原子核外电子排布式为:1s22s22p63s23p63d74s2,以上两种元素核外未成对电子数目都为3;
(4)(CH3)3Ga中Ga形成3个σ键,没有孤电子对,所有Ga原子的杂化方式为sp2杂化;As与N同主族位于第VA族,其氢化物的结构与氨气相同,则AsH3分子的空间构型为三角锥形;
(4)N原子半径较小,电负性较大,对应的NH3分子间能形成氢键,沸点较高,而As电负性小,半径大,分子间不能形成氢键,沸点较低;
(6)GaAs为原子晶体,原子间以共价键结合,利用均摊法计算一个晶胞中含有的As、Ga原子数,As:8×18+6×12=4,Ga:4×1=4,即一个晶胞中含有4个GaAs;晶胞的质量m=![]() g,晶胞的体积V=(apm)3=(a×10-10cm)3=a3×10-30cm3,则晶胞的密度=
g,晶胞的体积V=(apm)3=(a×10-10cm)3=a3×10-30cm3,则晶胞的密度=![]() =
=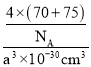 =
=![]() 。
。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。

(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第________周期第__________族,元素符号是________,最外电子层的电子排布式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某科研机构研究表明,利用K2Cr2O7可实现含苯酚废水的有效处理,其工作原理如下图所示。下列说法正确的是
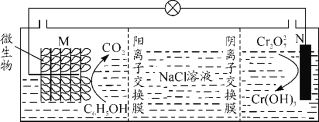
A.N为该电池的负极
B.该电池可以在高温下使用
C.一段时间后,中间室中NaCl溶液的浓度减小
D.M的电极反应式为:C6H5OH+28e-+11H2O=6CO2↑+28H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是典型的半导体材料,在光照射下导电性可提高近千倍。如图是从某工厂的硒化银半导体废料(含Ag2SeO、Cu 单质)中提取硒、银的工艺流程图:
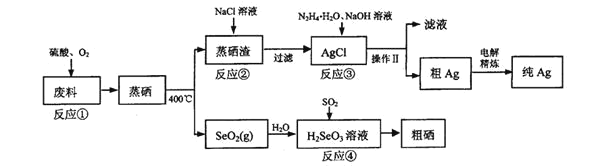
回答下列问题:
(1)写出 Se 的原子结构示意图_______。
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子程式_______。
(3)已知:常温下Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图所示,反应②为_______(写离子方程式);该反应的化学平衡常数的数量级为_______。

(4)写出反应④的化学方程式________。
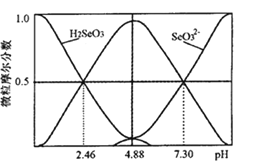
(5)室温下,H2SeO3水溶液中的H2SeO3、HSeO3-、SeO32-摩尔分数随 pH 的变化如图 所示,则室温下 SeO32-的 Kh_______。
(6)工业上粗银电解精炼时,电解液的pH为1.5~2,电流强度为5~10A,若电解液pH太小,电解精炼过程中在阴极除了银离子放电,还会发生_______(写电极反应式),若用 10A 的电流电解 60min 后,得到32.4gAg,则该电解池的电解效率为_______(保留小数点后一位)。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率,法拉第常数为96500C·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,不正确的是( )

A.HA的电离方程式为:HA=H++A- B.MOH为一元弱碱
C.K点对应的溶液中有:c(MOH)+c(M+)=0.02mol ![]() L-1 D.N点对应的溶液中有:c(M+)=c(A-)
L-1 D.N点对应的溶液中有:c(M+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) △H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示:
2NO2(g) △H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示:
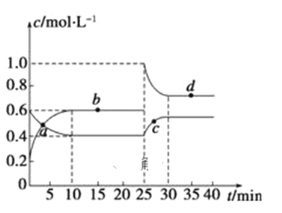
(1)该温度下,若温度升高,K值将___________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是_____点。
(3)25 min时,加入了___________填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_____(填“大于”、“小于”或“等于”)0.8 mol/L,理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol·L-1。若在5 mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8 mL 0.01 mol·L-1AgNO3溶液,下列叙述正确的是( )
A.混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
B.混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
C.加入AgNO3溶液时首先生成AgCl沉淀
D.混合溶液中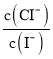 约为1.02×10-3
约为1.02×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
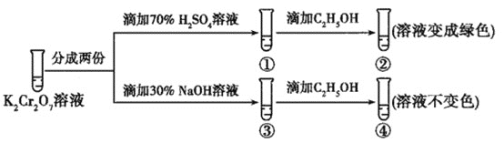
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究卤代烃的化学性质,某化学课外小组的学生进行了如下实验。
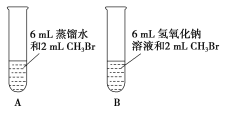
(1)甲同学设计了A、B两个实验,充分振荡反应后,甲先从试管A的水层中取出少量溶液,滴入盛装有硝酸酸化的硝酸银溶液的试管中,观察到的实验现象是____;后从试管B(NaOH溶液的浓度是0.5 mol·L-1)的水层中取出少许溶液,滴入盛有足量硝酸酸化的硝酸银溶液的试管中,观察到的实验现象是____,写出该反应的化学方程式:____。A、B两个实验说明____。
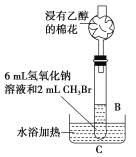
(2)乙同学在B的基础上设计装置C,研究氢氧化钠溶液和CH3Br的反应。浸有乙醇的棉花的作用是____,有人认为,控制装置C中水浴温度是本实验的关键,则应控制水浴温度低于____的沸点。
(3)丙同学将NaOH溶液的浓度从0.5 mol·L-1增大到1.0 mol·L-1、1.5 mol·L-1,经过相同的时间(试管中还有油滴)后从试管B的水层中取出少许溶液,滴入盛有足量硝酸酸化的硝酸银溶液的试管中,发现生成沉淀的质量依次增大,该现象说明____,还可以通过其他实验操作说明该结论,简述另一种实验思想:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com