
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu + H2O |
方法c | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+![]() O2(g)=Cu2O(s)△H =-169kJ·mol-1
O2(g)=Cu2O(s)△H =-169kJ·mol-1
C(s)+![]() O2(g)=CO(g)△H =-110.5kJ·mol-1
O2(g)=CO(g)△H =-110.5kJ·mol-1
Cu(s)+![]() O2(g)=CuO(s)△H =-157kJ·mol-1
O2(g)=CuO(s)△H =-157kJ·mol-1
则方法a发生反应的热化学方程式是_____________________________________。
(2)方法b采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为______________________________________。

(3)方法c为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为________________________________________。
(4)在容积为1L的恒容密闭容器中,用以上方法制得的三种纳米级Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。
2H2(g)+O2(g),ΔH>0。水蒸气的浓度c随时间t的变化如下表所示。

①对比实验的温度:T2_________T1(填“>”、“<”或“=”)
②催化剂催化效率:实验①________实验②(填“>”或“<”)
③在实验③达到平衡状态后,向该容器中通入水蒸气与氢气各0.1mol,则反应再次达到平衡时,容器中氧气的浓度为 ____________________。
【答案】 C(s)+2CuO(s)==Cu2O(s)+CO(g) ΔH=+34.5 kJ·mol-1 阴 2Cu-2e-+2OH-=Cu2O+H2O 4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O > < 0.025 mol/L
2Cu2O+N2↑+6H2O > < 0.025 mol/L
【解析】(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H =-169kJ·mol-1
O2(g)=Cu2O(s)△H =-169kJ·mol-1
②C(s)+![]() O2(g)=CO(g)△H =-110.5kJ·mol-1
O2(g)=CO(g)△H =-110.5kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s)△H =-157kJ·mol-1
O2(g)=CuO(s)△H =-157kJ·mol-1
由①+②-③![]() 得C(s)+2CuO(s)==Cu2O(s)+CO(g),ΔH= -169 kJ·mol-1+(-110.5kJ·mol-1)-(-157kJ·mol-1)
得C(s)+2CuO(s)==Cu2O(s)+CO(g),ΔH= -169 kJ·mol-1+(-110.5kJ·mol-1)-(-157kJ·mol-1)![]() =+34.5kJ·mol-1则方法a发生反应的热化学方程式是C(s)+2CuO(s)==Cu2O(s)+CO(g) ΔH=+34.5kJ·mol-1。
=+34.5kJ·mol-1则方法a发生反应的热化学方程式是C(s)+2CuO(s)==Cu2O(s)+CO(g) ΔH=+34.5kJ·mol-1。
(2)方法b采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,则铜为阳极,阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O,由于阳极需要OH-参与反应,所以该电池中离子交换膜为阴离子交换膜。
(3)方法c为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O。
2Cu2O+N2↑+6H2O。
(4)①水的分解是吸热反应,温度越高,水的转化率越高,压强越大,水的转化率越小。由表中数据可知,T2温度下水蒸气的转化率最大(50%),所以实验的温度T2>T1。
②由表中数据可知,实验①在第20min达到平衡,而实验②在第10min即达到平衡,所以,催化剂催化效率:实验①<实验②。
③在实验③达到平衡状态后,由表中数据可以求出氧气的平衡浓度为0.025mol/L,该反应的平衡常数K=0.025。向该容器中通入水蒸气与氢气各0.1mol之后,Qc=0.025=K,说明已达平衡,则容器中氧气的浓度仍为0.025mol/L。


科目:高中化学 来源: 题型:
【题目】燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是__________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程的变化曲线_____________。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO 通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如右图所示:
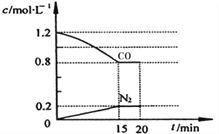
①有害气体NO的转化率为________, 0~15min NO的平均速率v(NO)=______mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将___________移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是____________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组对碳与浓硝酸的反应进行探究,已知:2NaOH+2NO2=NaNO3+NaNO2+H2O,2NaOH+NO2+NO=2NaNO2+H2O。请回答下列可题:
I.甲同学设计 如图所示装置制备并收集NO
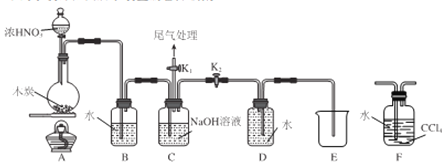
(1)碳与浓硝酸反应的化学方程式为__________________。
(2)C的作用为_______________。
(3)乙同学认为用装置F代替B更合理,理由为_______________。
(4)乙同学用改进后的装置进行实验。
①将浓HNO3滴入圆底烧瓶中的操作为__________________。
②点燃A处酒精灯开始反应后,圆底烧瓶中的现象为________________。
II.探究NO与Na2O2反应
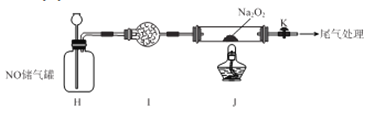
已知NaNO2既有氧化性,又有还原性;J 处硬质玻璃管中制得的NaNO2中含有少量NaNO3。
(5)检验上图装置气密性的方法为____________________。
(6)实验结束后,设计实验证明J 处硬质玻璃管中有NaNO2生成________________。
供选试剂:蒸馏水KI-淀粉溶液,KMnO4溶液、NaOH溶液.BaCl2溶液、稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味。请回答以下问题:
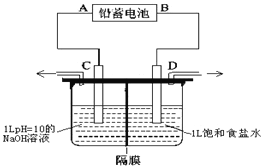
(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则A极为电源的_________极(填“正”或“负”),电极反应为___________________________;
(2)电解饱和食盐水的离子反应方程式是__________________;
(3)电极C的电极反应是_____________________________________________;
(4)电解时为防止两种气体产物混合,用阳离子交换膜做隔膜。则电解时Na+从______极区移向_____极区(填“C”或“D”);
(5)若电路上有0.2mol电子的电量通过,则铅蓄电池中消耗硫酸_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1780年,意大利解剖学家伽伐尼在用银质手术刀触碰放在铁盘上的青蛙时,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。伽伐尼认为出现这种现象的原因是动物体内存在“生物电”。结合你所学的知识模拟该过程,下列哪种材质的手术刀触碰铁盘上的青蛙腿不会产生触动_________(填字母)。
a、铝 b、玻璃 c、银 d、铁
(2)1799年,伏打仔细研究了伽伐尼的发现,以含食盐水的湿抹布,夹在银和锌的圆形版中间,堆积成圆柱状,制造出世界上最早的电池-伏打电池。将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
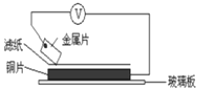
金属 | 电子流动方向 | 电压(V) |
A | A→Cu | +0.78 |
B | Cu→B | -0.15 |
D | D→Cu | +1.35 |
E | E→Cu | +0.30 |
已知:构成两电极的金属其金属活泼性相差越大,电压表的读数越大。请依据表中数据判断:_______金属可能是最强的还原剂;______金属一定不能从硫酸铜溶液中置换出铜。
(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,下图是丹尼尔电池的简易装置:
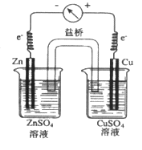
该电池的正极反应是_____________,负极反应 __________。
(4)随着社会的发展和科技的进步,越来越多的电池被制造出来。请选择适宜的材料和试剂设计一个原电池,使它的正极反应为:Fe3++e-=Fe2+以“![]() ”代表反应容器,“
”代表反应容器,“![]() ”代表导线,“
”代表导线,“![]() ”代表电极,“
”代表电极,“![]() ”代表小灯泡,
”代表小灯泡,
在下图方框内画出装置图并指出电极材料和电解质溶液,标出电源的正负极________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)标准状况下,①6.72 L NH3 ②1.204×1023个 H2S ③5.6 g CH4 ④0.5 mol HCl ,下列关系按由大到小排序
A.体积大小:___________________ B.质量大小:________________
C.密度大小:___________________D.原子数目:_________________
(2)标准状况下,33.6 L的HCl所具有的物质的量为_____________,将其溶解于水配成3 L的溶液,所得盐酸的物质的量浓度为__________。
(3)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________
(4)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为_________
(5)0.5 L 1 mol/L CaCl2溶液中Ca2+的物质的量为_________,Cl的物质的量浓度为________
(6)0.3 mol NH3分子中所含原子数与___________个H2O分子中所含原子数相等
相同质量的SO2、SO3的物质的量之比为____________;氧原子的个数之比为___________
在0℃和101kPa的条件下,将2.00g氦气、1.40g氮气和1.60g氧气混合,该混合气体的体积是________L
若1gN2含a个原子,则阿伏加德罗常数可表示为_____________
由硫酸钾、硫酸铁和硫酸组成的混合溶液,其中c(H+)=0.1 mol/L,c(Fe3+)=0.3 mol/L,c(SO![]() )= 0.6 mol/L,则c(K+)为________
)= 0.6 mol/L,则c(K+)为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL浓度为2mol/L的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成的氢气的总量,可采用的方法是( )
A. 加入适量的6mol/L的硫酸 B. 适当加热
C. 加入适量蒸馏水 D. 加入适量的稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)在一定条件下将CO2和H2转化为甲醇蒸气和水蒸气的相关反应有:
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H1=+41KJ/mol
CO(g)+H2O(g) △H1=+41KJ/mol
CO(g)+2 H2(g)![]() CH3OH(g) △H2=-90KJ/mol
CH3OH(g) △H2=-90KJ/mol
则由甲醇蒸气和水蒸气转化为CO2和H2的热化学方程式为___________________。
(2)在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3<0.
CH3OH(g)+H2O(g) △H3<0.
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
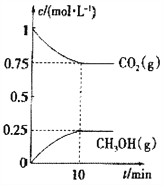
①能说明该反应已达平衡状态的是______________。
A.单位时间内有3nmolH—H键断裂,同时又有2nmolO—H键断裂
B.混合气体的平均相对分子质量不随时间变化
C.混合气体的密度不随时间变化
D.体系中n(CO2)/n(H2)=1∶1,且保持不变
②下列措施能使n(CH3OH)/n(CO2)增大的是__________。
A.升高温度B.恒温恒容下,再充入2molCO2、3molH2
C.使用高效催化剂 D.恒温恒容充入He(g)使体系压强增大
③已知该温度下此反应的平衡常数K=0.198,若使K的值变为1,应采取的措施是___________。
A.升高温度 B.降低温度 C.增大压强 D.恒压加入一定量H2
(3)捕捉CO2可以利用Na2CO3溶液。用100mL0.1 mol/LNa2CO3溶液完全捕捉0.44gCO2气体(溶液体积不变),所得溶液中c(HCO3-)+c(CO32-)+c(H2CO3)=__________mol/L
(4)用CO2和天然气可以制备CO和H2,CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4 的平衡转化率与温度及压强的关系如图所示,则压强P1 ____P2(填“>”或“<”)。若P2=3MPa,则T°C时该反应的平衡常数Kp =_____MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4 的平衡转化率与温度及压强的关系如图所示,则压强P1 ____P2(填“>”或“<”)。若P2=3MPa,则T°C时该反应的平衡常数Kp =_____MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜品醇可作为消毒剂、抗氧化剂、溶剂和医药中间体。合成α-萜品醇(G)的路线之一如下:

其中E的化学式为C8H12O2,请回答下列问题:
(1)A中含有的官能团名称是________;C的结构简式为________。
(2)由化合物C制取化合物D的反应类型为________;有人提出可以由化合物B直接在浓硫酸中加热也可以获得化合物E,但很快遭到反对,你认为可能原因是_________________________________。
(3)试写出由化合物E制取化合物F的化学方程式:_______________________________________。
(4)化合物A满足下列条件的同分异构体有________种。
a.为链状有机物且无支链
b.能发生银镜反应
c.能和碳酸氢钠反应生成气体
(5)下列说法正确的是________(填写序号)。
a.A的核磁共振氢谱有4种峰
b.B可与FeCl3溶液发生显色反应
c.G中所有原子可能在同一平面上
d.G可以使溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com