
【题目】烟气(主要成分CO2、CO、SO2、NOX) 的排放对环境有很大的影响。
I.利用氨水作吸收液是当前有效捕捉CO2的方法,经过可逆反应生成NH4HCO3。生成的NH4HCO3分解可得到CO2,从而实现吸收液的再生。
(1)写出氨水捕捉CO2 的化学方程式 。
(2)已知:NH4HCO3 溶液显碱性,下列说法不正确的是 。
a.c(NH3·H2O)>c(H2CO3)
b.c(NH4+)>c(HCO3—)>c(OH—)>c(H+)
c.c(NH3·H2O)+c(NH4+)=c(H2CO3)+c(HCO3—)
d.c(HCO3—)+2c(CO32—)+c(OH—)=c(H+)+c(NH4+)
(3)如图是氨水吸收CO2 的脱除率随温度变化的关系图。
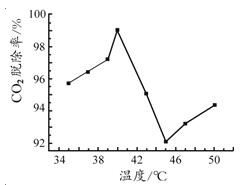
应用平衡移动原理分析 CO2 在 40℃-45℃ 脱除率降低可能的原因 。
II.SO2、NOX 可以经 O3 预处理后用 CaSO3 水悬浮液吸收,可减少烟气中SO2、NOX 的含量。O3 氧化烟气中 NOX 的主要反应的热化学方程式为:
(4)用CaSO3水悬浮液吸收烟气中NO2时,清液 ( pH约为8) 中SO32-将NO2转化为NO2-,其离子方程式为 。
(5)CaSO3水悬浮液中加入Na2SO4溶液能提高NO2 的吸收速率,用平衡移动原理解释其主要原因是 。
【答案】(1)CO2+NH3·H2O![]() NH4HCO3(2分)(2)ac(2分)
NH4HCO3(2分)(2)ac(2分)
(3)氨水吸收CO2为放热反应,在40~45℃升高温度平衡向左移动,使CO2脱除率降低。(其它合理答案均给分)(2分)
(4)SO32-+2NO2+2OH-=SO42-+2NO2-+H2O(2分)
(5)CaSO3(s)![]() Ca2+(aq)+SO32-(aq),加入Na2SO4溶液,SO42-结合Ca2+,c(Ca2+)降低,使上述平衡向右移动,c(SO32-)增大,提高NO2的吸收速率(2分)
Ca2+(aq)+SO32-(aq),加入Na2SO4溶液,SO42-结合Ca2+,c(Ca2+)降低,使上述平衡向右移动,c(SO32-)增大,提高NO2的吸收速率(2分)
【解析】
试题分析: I.(1)氨水捕捉 CO2 的化学方程式CO2 + NH3·H2O![]() NH4HCO3;
NH4HCO3;
(2)a、越弱越水解,谁强显谁性,NH4HCO3 溶液显碱性,说明HCO3-水解程度大于NH4+,所以c(NH3·H2O)<c(H2CO3),a错误;b、NH4HCO3 溶液显碱性,说明HCO3-水解程度大于NH4+,所以c(NH4+)> c(HCO3-)>c(OH-)>c(H+),b正确;c、根据物料守恒c (NH3·H2O) + c(NH4+)= c(H2CO3)+ c(HCO3-)+ c (CO32-),c错误;d、根据电荷守恒c(HCO3-)+2c(CO32-)+ c(OH-)=c(H+)+c(NH4+),d正确;答案选ac;
(3)氨水吸收CO 2为放热反应,在40~45℃升高温度平衡向左移动,使CO2 脱除率降低。
(4)NO2被还原为NO2-,则SO32-被氧化为SO42-,其离子方程式为SO32-+2NO2+2OH- =SO42-+2NO2-+H2O;
(5)亚硫酸钙存在溶解平衡:CaSO3(s)![]() Ca2+(aq)+ SO32-(aq),加入Na2SO4溶液,SO42-结合Ca2+,使 c(Ca2+)降低,使上述平衡向右移动,c(SO32-)增大,提高NO2的吸收速率。
Ca2+(aq)+ SO32-(aq),加入Na2SO4溶液,SO42-结合Ca2+,使 c(Ca2+)降低,使上述平衡向右移动,c(SO32-)增大,提高NO2的吸收速率。


科目:高中化学 来源: 题型:
【题目】取三份不同组成镁铝混合物分别加入1mol/L的盐酸,待混合完全溶解后,往溶液中加入1mol/L的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如下所示.下列说法中错误的是

A.图I中a的取值范围为0≤a<≤50
B.图I中![]() 的最大值为2.5
的最大值为2.5
C.图II中a的取值范围为80<a<96.7
D.图III中a的取值范围为75<a<80
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示实验装置,回答下列问题:

(1)写出下列仪器的名称:①___________,②___________,④___________,⑤___________。
(2)若利用装置I分离酒精和水的混合物,还缺少的仪器是_______________;在实验中,仪器①中加入沸石的作用是___________________;②的进水口是_______________(填“f”或“g”)。
(3)使用装置II进行的实验操作名称为___________,实验前需进行的操作为___________。
(4)若在实验室中进行石油的分离实验,应选择的实验装置是___________(填“I”或“II”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质能与H2反应
H2+F2=2HF | 在暗处能剧烈化合并发生爆炸 |
H2+Cl2=2HCl | 光照或点燃发生反应 |
H2+Br2=2HBr | 加热至一定温度才能反应 |
H2+I2=2HI | 不断加热才能缓慢反应,生成的HI会分解 |
(1)卤族元素位于周期表中的______________族。
(2)用电子式表示HCl的形成过程______________。
(3)依据上表,可以推测出:随着原子序数的递增,___________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全部流下排出,用量筒承接,该溶液的体积应为
A. 10mL B. 40mL C. 大于40mL D. 小于40ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下KClO3与I2按下式反应:2KClO3+I2===2KIO3+Cl2,则下列推断正确的是( )
A.I2发生还原反应
B.氧化剂为I2
C.还原剂为KClO3
D.反应中KClO3被还原为Cl2,I2被氧化为KIO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com