
【题目】有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全部流下排出,用量筒承接,该溶液的体积应为
A. 10mL B. 40mL C. 大于40mL D. 小于40ml
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组对NO与Na2 O2 的反应进行了探究。通过查阅资料可知:①NO不与碱反应;②亚硝酸盐除浅黄色的AgNO2难溶于水外,其它都易溶于水;③2NaNO3![]() 2NaNO2+O2↑,NaNO2 热稳定性很高。
2NaNO2+O2↑,NaNO2 热稳定性很高。
【实验探究Ⅰ】兴趣小组的同学经讨论设计了如下图所示实验:
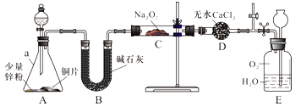
(1)装置B的作用是______________;
(2)在分液漏斗中加稀硝酸之前,先加入少量稀硫酸让A中锌粉完全溶解,其目的是____;
(3)实验观察到C中固体颜色变白,E中气体先变红棕色,最终又变无色。E中总反应的化学方程式是_________________。
【实验探究Ⅱ】 该兴趣小组进一步探究C中生成的白色固体的成分。
(4)提出假设:
假设1.白色固体只有NaNO3 ;
假设2.白色固体只有_________________;
假设3.白色固体是两种物质的混合物。
(5)实验验证:
①根据查阅的资料,要证明假设1是否成立,需要用到的试剂为____________________;
②为证明是假设2还是假设3成立,称取C中生成的白色固体m g置于坩埚中(坩埚质量为ag),用酒精灯加热至质量不再改变,若假设3成立,则冷却后称得剩余固体总质量n的范围是_______。(用含字母的不等式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气(主要成分CO2、CO、SO2、NOX) 的排放对环境有很大的影响。
I.利用氨水作吸收液是当前有效捕捉CO2的方法,经过可逆反应生成NH4HCO3。生成的NH4HCO3分解可得到CO2,从而实现吸收液的再生。
(1)写出氨水捕捉CO2 的化学方程式 。
(2)已知:NH4HCO3 溶液显碱性,下列说法不正确的是 。
a.c(NH3·H2O)>c(H2CO3)
b.c(NH4+)>c(HCO3—)>c(OH—)>c(H+)
c.c(NH3·H2O)+c(NH4+)=c(H2CO3)+c(HCO3—)
d.c(HCO3—)+2c(CO32—)+c(OH—)=c(H+)+c(NH4+)
(3)如图是氨水吸收CO2 的脱除率随温度变化的关系图。
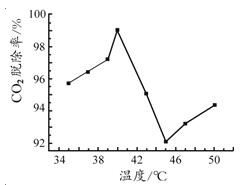
应用平衡移动原理分析 CO2 在 40℃-45℃ 脱除率降低可能的原因 。
II.SO2、NOX 可以经 O3 预处理后用 CaSO3 水悬浮液吸收,可减少烟气中SO2、NOX 的含量。O3 氧化烟气中 NOX 的主要反应的热化学方程式为:
(4)用CaSO3水悬浮液吸收烟气中NO2时,清液 ( pH约为8) 中SO32-将NO2转化为NO2-,其离子方程式为 。
(5)CaSO3水悬浮液中加入Na2SO4溶液能提高NO2 的吸收速率,用平衡移动原理解释其主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
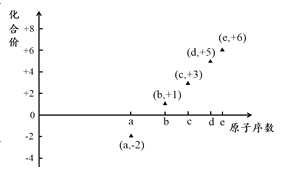
A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. 工业上常用电解法制备单质b和c
D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于微量元素的一组是( )
A. Cl、Fe、S、N、Cu B. B、Cl、Zn、Mn、Mo
C. C、H、N、P、Mn D. N、P、K、B、Fe、I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。

已知:2Fe2++Br2=2Fe3++2Br-
2Fe3++2I-=2Fe2++I2
(1)Fe2+、I-、Br-的还原性由强到弱排列顺序为 。
(2)C→D代表 离子浓度的变化。
(3)当通入1mol Cl2时,溶液中已发生的离子反应可表示为: 。
(4)原溶液中:n(Fe2+):n(I-):n(Br-)= 。
(5)通入2mol Cl2时,溶液中已发生的离子反应可表示为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3—的方程式: 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
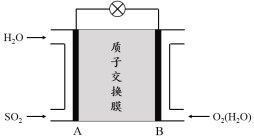
① 质子的流动方向为 (“从A到B”或“从B到A”)。
② 负极的电极反应式为 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
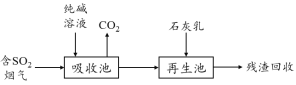
① 用纯碱溶液吸收SO2将其转化为HSO3—,反应的离子方程式是 。
② 若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是重要的化工原料。某实验室对氨气进行下列研究。
(1)相同温度下,在三个体积均为2.0L的恒容密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),反应过程中测定的部分数据见下表:
2NH3(g),反应过程中测定的部分数据见下表:
容器编号 | 起始各物质的物质的量/mol | 平衡物质的量(mol) | 平衡压强(Pa) | ||
N2(g) | H2(g) | NH3(g) | NH3(g) | ||
Ⅰ | 4 | 12 | 0 | 4 | P1 |
Ⅱ | 2 | 6 | 0 | C2 | P2 |
Ⅲ | 1.5 | 4.0 | 3 | ? | ? |
①若容器Ⅰ中反应50秒到达平衡,则该时段v(H2)= mol/(L·s)
②容器Ⅰ、Ⅱ中反应均到达平衡时c2 2;p1 2p2(填“>”、“<”或“=”)
③容器Ⅲ中,达到平衡前v(正) v(逆) (填“>”、“<”或“=”)
(2)①已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g)=2NO(g) △H=180.5 kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol
则4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H= KJ/mol
4NO(g)+6H2O(g);△H= KJ/mol
②将4molNH3和5molO2分别置于5个体积相同、温度不同的容器中在铂系催化剂作用下进行反应,相同时间后测量5个容器中N产率如图所示。下列说法正确的是 (填字母)。
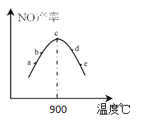
A.a点v(正)大于v(逆)
B.c点反应速率最快
C.温度高于900℃时,NO产率下降的原因是因为温度升高导致平衡逆向移动
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)。则该燃料电池的负极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料。
(1)工业上主要用TiO2氯化的方法来制取TiCl4
① 有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)![]() TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因 。
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如下:
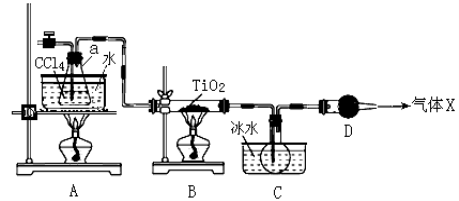
下表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
① 实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 。
② 本实验中仪器a采用题给的加热方式的突出优点是 。
③ B中CCl4与TiO2发生反应的化学方程式是 。
④ 欲分离C装置中的TiCl4,应采用的实验操作为 (填操作名称)。
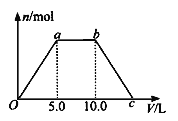
⑤ 若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com