
【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料。
(1)工业上主要用TiO2氯化的方法来制取TiCl4
① 有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)![]() TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因 。
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如下:
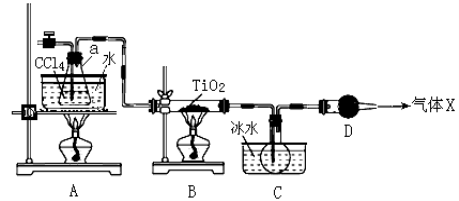
下表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
① 实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 。
② 本实验中仪器a采用题给的加热方式的突出优点是 。
③ B中CCl4与TiO2发生反应的化学方程式是 。
④ 欲分离C装置中的TiCl4,应采用的实验操作为 (填操作名称)。
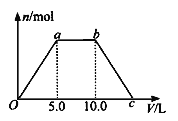
⑤ 若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 。
【答案】(1)①MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;②加入的碳单质与氧气反应,减小了产物O2的浓度,使反应TiO2(s)+2Cl2(g)TiCl4(l)+O2(g)平衡向正反应方向移动,促进反应能够顺利进行。
Mn2++Cl2↑+2H2O;②加入的碳单质与氧气反应,减小了产物O2的浓度,使反应TiO2(s)+2Cl2(g)TiCl4(l)+O2(g)平衡向正反应方向移动,促进反应能够顺利进行。
(2)①先排尽系统(装置)中的空气;②受热均匀,能为反应提供稳定的CCl4蒸汽流;
③TiO2+CCl4![]() TiCl4+CO2;④蒸馏;⑤NaHCO3;BaCO3+H2O+CO2=Ba2++2HCO3-
TiCl4+CO2;④蒸馏;⑤NaHCO3;BaCO3+H2O+CO2=Ba2++2HCO3-
【解析】
试题分析:(1)①实验室用二氧化锰与浓盐酸在加热条件下反应生成二氯化锰、氯气和水,离子方程式为MnO2 +4H++2Cl-![]() Mn2++Cl2 ↑+2H2O;② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使反应 TiO2(s)+2Cl2(g)TiCl4(l)+O2(g)平衡向正反应方向移动,促进反应能够顺利进行。
Mn2++Cl2 ↑+2H2O;② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使反应 TiO2(s)+2Cl2(g)TiCl4(l)+O2(g)平衡向正反应方向移动,促进反应能够顺利进行。
(2)① 根据题给信息知TiCl4遇潮湿空气产生白雾,故实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是先排尽系统(装置)中的空气。② 本实验中仪器a采用题给的加热方式为水浴加热,突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流。③ B中CCl4与TiO2发生反应生成TiCl4和二氧化碳,化学方程式是TiO2+CCl4![]() TiCl4+CO2。④ C装置中为四氯化碳和四氯化钛的混合物,二者沸点不同,故欲分离C装置中的TiCl4,应采用的实验操作为蒸馏。⑤将反应过程中生成的气体二氧化碳缓缓通入Ba( OH)2和NaOH的混合稀溶液中,发生的反应依次为:Oa段:CO2+Ba(OH)2
TiCl4+CO2。④ C装置中为四氯化碳和四氯化钛的混合物,二者沸点不同,故欲分离C装置中的TiCl4,应采用的实验操作为蒸馏。⑤将反应过程中生成的气体二氧化碳缓缓通入Ba( OH)2和NaOH的混合稀溶液中,发生的反应依次为:Oa段:CO2+Ba(OH)2![]() BaCO3↓+H2O;ab段:CO2+2NaOH
BaCO3↓+H2O;ab段:CO2+2NaOH![]() Na2CO3+H2O、CO2+Na2CO3+H2O
Na2CO3+H2O、CO2+Na2CO3+H2O![]() 2NaHCO3;bc段:CO2+BaCO3+H2O
2NaHCO3;bc段:CO2+BaCO3+H2O![]() 2Ba(HCO3)2。b点溶液中溶质主要成分的化学式为NaHCO3,从b点到c点,沉淀减少过程中发生反应的离子方程式为BaCO3 + H2O+CO2 = Ba2+ +2HCO3-。
2Ba(HCO3)2。b点溶液中溶质主要成分的化学式为NaHCO3,从b点到c点,沉淀减少过程中发生反应的离子方程式为BaCO3 + H2O+CO2 = Ba2+ +2HCO3-。


科目:高中化学 来源: 题型:
【题目】有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全部流下排出,用量筒承接,该溶液的体积应为
A. 10mL B. 40mL C. 大于40mL D. 小于40ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下KClO3与I2按下式反应:2KClO3+I2===2KIO3+Cl2,则下列推断正确的是( )
A.I2发生还原反应
B.氧化剂为I2
C.还原剂为KClO3
D.反应中KClO3被还原为Cl2,I2被氧化为KIO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以利用废气中的CO2为原料制取甲醇。请回答下列问题:
(1) 已知常温常压下,下列两个可逆反应的能量变化如下图所示:
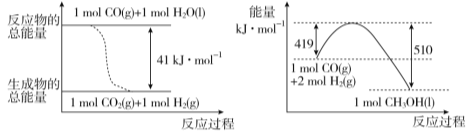
请写出左图反应的平衡常数表达式K= 。
请写出由二氧化碳和氢气制备甲醇的热化学方程式 。
(2) 如果只改变一个条件使上述反应方程式的平衡常数K值变大,则该反应________(选填编号)。
A.一定向正反应方向移动 B.在平衡移动时,正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时,逆反应速率先减小后增大
(3) 在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________(填字母)。
A.H2的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时,n(H2)/n(CH3OH)增大
(4) 保持温度和体积不变,通入1molCO2和3molH2,下列能说明该反应已达平衡状态的是________(填字母)。
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CO2的消耗速率之比为3∶1
D.容器内气体的平均相对分子质量保持不变
(5) 若反应容器的容积为2.0 L,反应时间4.0 min,容器内气体的密度减少了2.0 g·L-1。在这段时间内CO2的平均反应速率为_______________
(6) 有人设计甲醇-空气燃料电池电源,用石墨作电极电解200 mL含有下列离子的溶液:
离子 | Cu2+ | H+ | Cl- | SO |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,标况下当两极收集到相同体积的气体时,阳极上收集到氧气的质量为____________(忽略溶液体积的变化及电极产物可能存在的溶解现象)。也有人用此电源利用电解法制备Na2FeO4,阳极材料为铁,其电解质溶液用NaOH溶液,阳极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
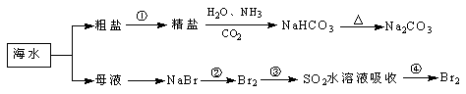
A.工业上通过电解熔融状态MgCl2制取金属镁
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第②、④步骤中,溴元素均被氧化
D.制取NaHCO3的反应是利用其溶解度小于NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对细胞中某些物质的组成进行分析,可以作为鉴定真核生物的不同个体是否为同一物种的辅助手段,一般不采用的物质是
A. 核苷酸 B. DNA C. RNA D. 蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是
A. 氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同
B. 氢氧化铁胶体粒子在电场的影响下将向阴极移动,说明氢氧化铁胶体带正电。
C. 向某溶液中加入NaOH溶液后再滴加红色石蕊试液变蓝说明溶液中含有NH4+
D. 已知298K时,合成氨反应N2(g) +3H2(g)![]() 2NH3(g) △H=-92.0kJ/mol ,在密闭容器中加入一定量反应物达平衡后生成0.2mol NH3,测得反应放出的热量为9.20kJ
2NH3(g) △H=-92.0kJ/mol ,在密闭容器中加入一定量反应物达平衡后生成0.2mol NH3,测得反应放出的热量为9.20kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
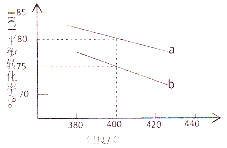
【题目】对于反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g),下图是两种投料比[n(HCl):(O2)分别为4:1和2:1]下,反应温度对HCl平衡转化率影响的曲线。则投料比为4:1、溺度为400℃时,平衡混合物中Cl2的体积分数是( )
2Cl2(g)+2H2O(g),下图是两种投料比[n(HCl):(O2)分别为4:1和2:1]下,反应温度对HCl平衡转化率影响的曲线。则投料比为4:1、溺度为400℃时,平衡混合物中Cl2的体积分数是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com