
����Ŀ��NH3����Ҫ�Ļ���ԭ�ϡ�ijʵ���Ҷ������������о���
��1����ͬ�¶��£������������Ϊ2.0L�ĺ����ܱ������з�����Ӧ��N2(g)��3H2(g) ![]() 2NH3(g)����Ӧ�����вⶨ�IJ������ݼ��±���
2NH3(g)����Ӧ�����вⶨ�IJ������ݼ��±���
������� | ��ʼ�����ʵ����ʵ���/mol | ƽ�����ʵ���(mol) | ƽ��ѹǿ(Pa) | ||
N2(g) | H2(g) | NH3(g) | NH3(g) | ||
�� | 4 | 12 | 0 | 4 | P1 |
�� | 2 | 6 | 0 | C2 | P2 |
�� | 1.5 | 4.0 | 3 | ? | ? |
�����������з�Ӧ50�뵽��ƽ�⣬���ʱ��v(H2)= mol/(L��s)
���������з�Ӧ������ƽ��ʱc2 2;p1 2p2(�>������<����=��)
���������У��ﵽƽ��ǰv(��) v(��) (�>������<����=��)
��2������֪��N2(g)+3H2(g)![]() 2NH3(g) ��H=-92.4kJ/mol
2NH3(g) ��H=-92.4kJ/mol
N2(g)+O2(g)=2NO(g) ��H=180.5 kJ/mol
2H2(g)+O2(g)=2H2O(g) ��H=-483.6 kJ/mol
��4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)����H= KJ/mol
4NO(g)+6H2O(g)����H= KJ/mol
�ڽ�4molNH3��5molO2�ֱ�����5�������ͬ���¶Ȳ�ͬ���������ڲ�ϵ���������½��з�Ӧ����ͬʱ������5��������N������ͼ��ʾ������˵����ȷ���� (����ĸ)��
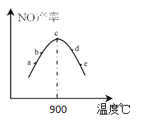
A��a��v(��)����v(��)
B��c�㷴Ӧ�������
C���¶ȸ���900��ʱ��NO�����½���ԭ������Ϊ�¶����ߵ���ƽ�������ƶ�
��3������һ��DZ�ڵ������Դ������������ȼ�ϵ�ص�ȼ�ϡ���ص��ܷ�ӦΪ��4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)�����ȼ�ϵ�صĸ�����Ӧʽ�� ��
���𰸡�
��1����0.06�� ��<��<����< ��
��2����-905����AC��
��3��2NH3��6e��+6OH��=N2+6H2O��
��������
�����������1���ٸ���N2(g)��3H2(g) ![]() 2NH3(g)������4mol��������Ҫ��Ӧ6mol���������������з�Ӧ50�뵽��ƽ�⣬���ʱ��v(H2)=
2NH3(g)������4mol��������Ҫ��Ӧ6mol���������������з�Ӧ50�뵽��ƽ�⣬���ʱ��v(H2)=![]() =0.06mol/(L��s)���ʴ�Ϊ��0.06��
=0.06mol/(L��s)���ʴ�Ϊ��0.06��
�������������ȣ����з�Ӧ������ʵ���Ϊ���е�2�����൱�ڶԢ���м�ѹ������ѹǿ��ƽ�������ƶ���ƽ��ʱc2��![]() c1����c2��2;p1��2p2���ʴ�Ϊ��<��<��
c1����c2��2;p1��2p2���ʴ�Ϊ��<��<��
����������ƽ��ʱ������Ϊ2mol������Ϊ6mol������Ϊ4mol��ƽ�ⳣ��K=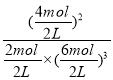 =
=![]() ����������Qc=
����������Qc=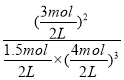 =
=![]() ��
��![]() ���ﵽƽ��ǰ��Ӧ���淴Ӧ�������v(��)��v(��)���ʴ�Ϊ��< ��
���ﵽƽ��ǰ��Ӧ���淴Ӧ�������v(��)��v(��)���ʴ�Ϊ��< ��
��2����N2(g)+O2(g)�T2NO(g)��H=+180.5kJ/mol ����N2(g)+3H2(g)�T2NH3(g)��H=-92.4kJ/mol ����2H2(g)+O2(g) �T2H2O(g) ��H=-483.6kJ/mol �����ɸ�˹���ɢ١�2-�ڡ�2+�ۡ�3�ã�4NH3(g)+5O2(g)�T4NO(g)+6H2O(g) ��H=-905.0kJ/mol���ʴ�Ϊ��4NH3(g)+5O2(g)=4NO(g)+6H2O(g)��H=-905.0kJ/mol���ʴ�Ϊ��-905��
�ڸ���ͼ��c��Ϊ900��ʱ��ƽ��״̬�������¶ȵ����ߣ�NO�IJ��ʽ��ͣ�ƽ�������ƶ���˵���߷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ��A��a���ǽ���ƽ��֮ǰ�Ĺ��̣�v(��)����v(��)����A��ȷ��B���¶�Խ�ߣ���Ӧ����Խ�죬��Ӧ����������e�㣬��B����C���¶ȸ���900��ʱ��NO�����½���ԭ������Ϊ�¶����ߵ���ƽ�������ƶ�����C��ȷ����ѡAC��
��3��ԭ��ظ�������������Ӧ�������ڸ���ʧȥ���ӣ��������������ɵ�����ˮ�������缫��ӦʽΪ��2NH3+6OH--6e-=N2+6H2O���ʴ�Ϊ��2NH3+6OH--6e-=N2+6H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2FeBr2��3Cl2===2FeCl3��2Br2�ķ�Ӧ�У���������Ԫ����( )
A��Fe B��Br C��Fe��Br D��Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ֧50mL��ʽ�ζ�������ʢ����Һ��Һ��ǡ����10mL�̶ȴ����ְѹ�����Һȫ�������ų�������Ͳ�нӣ�����Һ�����ӦΪ
A. 10mL B. 40mL C. ����40mL D. ��40ml
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ�����ԭ��ͭ�����ᆳ���������˺���CuSO4��Һ���������ʱ��������п��ZnS���ͷ�Ǧ��PbS)����������ת��Ϊͭ����CuS���������й��ù��̵Ľ�����˵������������
A��ԭ��ͭ���������л�ԭ��
B������ʱZnS��PbS��CuS��������ˮ��CuSO4������ˮ
C��ͭ�����γ���������ZnS(s)+Cu2+![]() CuS(s)+Zn2+
CuS(s)+Zn2+
D�����������겻����ͭ�����γɣ�CuS+2H+=Cu2++H2S��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������εĹ����ص���
A. ϸ������Դ����֮һ B. ijЩ��Ҫ���ӻ�����ijɷ�
C. ά��ϸ������ѹ�����ƽ�� D. ��ά��ϸ������̬�ͽṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D����ѧ��ѧ�ij�����������A��B��C������ͬһ��Ԫ�ء���һ������������֮����ת����ϵ��ͼ��ʾ(���ַ�Ӧ�е�H2O����ȥ)��
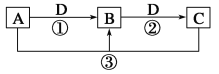
��ش��������⣺
��1����A����������ˮ������D�����������������������;���Ľ������ʣ���������B����Һ���ܵõ�B����B�Ļ�ѧʽ������_______________��������������ClO2����A������ԭ����Ҫ��
��2����A��һ�ּ������壬�������������B������β��֮һ�����������ɫ��A��NaClO��Ӧ�ɵõ���(N2H4)���÷�Ӧ�Ļ�ѧ����ʽΪ________________________��
��3����D���ȼҵ����Ҫ��Ʒ֮һ��B�����ԣ�����C��Һ�μ�С�մ���Һ��Ӧ�����ӷ���ʽ��__________________��
��4����A��C��D���dz������壬C�ǵ����������Ҫ���壬д��A�����������º�KMnO4��Ӧ��Һ���ֻ��ǵ����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������KClO3��I2����ʽ��Ӧ��2KClO3��I2===2KIO3��Cl2���������ƶ���ȷ����( )
A��I2������ԭ��Ӧ
B��������ΪI2
C����ԭ��ΪKClO3
D����Ӧ��KClO3����ԭΪCl2��I2������ΪKIO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ������÷����е�CO2Ϊԭ����ȡ�״�����ش��������⣺
(1) ��֪���³�ѹ�£������������淴Ӧ�������仯����ͼ��ʾ��
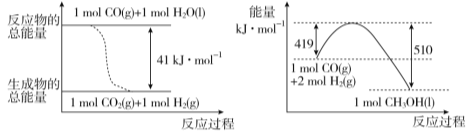
��д����ͼ��Ӧ��ƽ�ⳣ������ʽK= ��
��д���ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽ ��
(2) ���ֻ�ı�һ������ʹ������Ӧ����ʽ��ƽ�ⳣ��Kֵ�����÷�Ӧ________(ѡ����)��
A��һ��������Ӧ�����ƶ� B����ƽ���ƶ�ʱ������Ӧ������������С
C��һ�����淴Ӧ�����ƶ� D����ƽ���ƶ�ʱ���淴Ӧ�����ȼ�С������
(3) �������������������£����������ѹ����ԭ����1/2����ԭƽ����ȣ������й�˵����ȷ����________(����ĸ)��
A��H2��Ũ�ȼ�С B������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ�
C���״������ʵ������� D������ƽ��ʱ��n(H2)/n(CH3OH)����
(4) �����¶Ⱥ�������䣬ͨ��1molCO2��3molH2��������˵���÷�Ӧ�Ѵ�ƽ��״̬����________(����ĸ)��
A��n(CO2)��n(H2)��n(CH3OH)��n(H2O)��1��3��1��1
B��������ѹǿ���ֲ���
C��H2������������CO2����������֮��Ϊ3��1
D�������������ƽ����Է����������ֲ���
(5) ����Ӧ�������ݻ�Ϊ2.0 L����Ӧʱ��4.0 min��������������ܶȼ�����2.0 g��L-1�������ʱ����CO2��ƽ����Ӧ����Ϊ_______________
(6) ������Ƽ״�-����ȼ�ϵ�ص�Դ����ʯī���缫���200 mL�����������ӵ���Һ��
���� | Cu2+ | H+ | Cl- | SO |
c/(mol��L-1) | 0.5 | 2 | 2 | 0.5 |
���һ��ʱ�����µ������ռ�����ͬ���������ʱ���������ռ�������������Ϊ____________(������Һ����ı仯���缫������ܴ��ڵ��ܽ�����)��Ҳ�����ô˵�Դ���õ�ⷨ�Ʊ�Na2FeO4����������Ϊ������������Һ��NaOH��Һ��������ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ����������̿����ʹƷ����Һ��ɫ�����ǵ�Ư��ԭ����ͬ
B. �����������������ڵ糡��Ӱ���½��������ƶ���˵������������������硣
C. ��ij��Һ�м���NaOH��Һ���ٵμӺ�ɫʯ����Һ����˵����Һ�к���NH4+
D. ��֪298Kʱ���ϳɰ���ӦN2(g) +3H2(g)![]() 2NH3(g) ��H��-92.0kJ/mol �����ܱ������м���һ������Ӧ���ƽ�������0.2mol NH3����÷�Ӧ�ų�������Ϊ9.20kJ
2NH3(g) ��H��-92.0kJ/mol �����ܱ������м���һ������Ӧ���ƽ�������0.2mol NH3����÷�Ӧ�ų�������Ϊ9.20kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com