
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。

已知:2Fe2++Br2=2Fe3++2Br-
2Fe3++2I-=2Fe2++I2
(1)Fe2+、I-、Br-的还原性由强到弱排列顺序为 。
(2)C→D代表 离子浓度的变化。
(3)当通入1mol Cl2时,溶液中已发生的离子反应可表示为: 。
(4)原溶液中:n(Fe2+):n(I-):n(Br-)= 。
(5)通入2mol Cl2时,溶液中已发生的离子反应可表示为: 。
【答案】(1)I->Fe2+>Br-
(2)Fe2+
(3)Cl2+2I-=2Cl-+I2
(4)2:1:3
(5)2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
【解析】
试题分析:(1)反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-。故答案为:I->Fe2+>Br-;
(2)依据(1)的分析可知,离子被氧化的顺序为I-、Fe2+、Br-,所以C→D代表Fe2+的浓度变化。故答案为:Fe2+;
(3)通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,溶液中已经发生的离子反应可表示为:Cl2+2I-=2Cl-+I2。故答案为:Cl2+2I-=2Cl-+I2;
(4)依据坐标图可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3。故答案为:2:1:3;
(5)当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】充分燃烧一定量的丁烷气体放出的热量为Q,完全吸收它生成的CO2气体生成正盐,需5 mol·L-1的NaOH溶液100 mL,则丁烷的燃烧热为
A.16Q B.8Q C.4Q D.2Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质能与H2反应
H2+F2=2HF | 在暗处能剧烈化合并发生爆炸 |
H2+Cl2=2HCl | 光照或点燃发生反应 |
H2+Br2=2HBr | 加热至一定温度才能反应 |
H2+I2=2HI | 不断加热才能缓慢反应,生成的HI会分解 |
(1)卤族元素位于周期表中的______________族。
(2)用电子式表示HCl的形成过程______________。
(3)依据上表,可以推测出:随着原子序数的递增,___________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既是离子反应,又是氧化还原反应的是( )
A.2NaOH+H2SO4===Na2SO4+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.BaCl2+H2SO4===BaSO4↓+2HCl
D.H2+CuO===Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全部流下排出,用量筒承接,该溶液的体积应为
A. 10mL B. 40mL C. 大于40mL D. 小于40ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人体细胞中对生命活动起着重要作用,含量约占细胞鲜重总量97%的化学元素是
A. C、H、O、N、P、Ca B. C、H、O、N、P、K
C. C、H、O、N、S、K D. C、H、O、N、P、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界各种原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,并向深部渗透时,遇到闪锌矿(ZnS)和方铅矿(PbS),便慢慢地转变为铜蓝(CuS),下列有关该过程的解释及说法不合理的是
A.原生铜的硫化物具有还原性
B.常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水
C.铜蓝的形成过程是:ZnS(s)+Cu2+![]() CuS(s)+Zn2+
CuS(s)+Zn2+
D.硝酸型酸雨不利于铜蓝的形成:CuS+2H+=Cu2++H2S↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
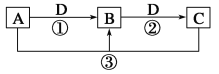
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是_______________;用新型消毒剂ClO2代替A消毒的原因主要有
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,A与NaClO反应可得到肼(N2H4),该反应的化学方程式为________________________。
(3)若D是氯碱工业的主要产品之一,B有两性,则向C溶液滴加小苏打溶液反应的离子方程式是__________________。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,写出A在酸性条件下和KMnO4反应溶液出现混浊的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
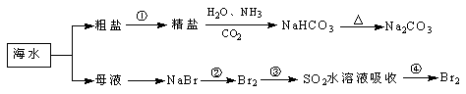
A.工业上通过电解熔融状态MgCl2制取金属镁
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第②、④步骤中,溴元素均被氧化
D.制取NaHCO3的反应是利用其溶解度小于NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com