
����Ŀ����6molA�����5molB�����Ϸ���4L�ܱ������У���һ�������·�����Ӧ��
3A������+B������ ![]() 2C������+��X D��������5min�ﵽƽ�⣬��ʱ����CΪ2mol ���ⶨD��ƽ����Ӧ����Ϊ0.1mol/Lmin������˵���д������ �� ��
2C������+��X D��������5min�ﵽƽ�⣬��ʱ����CΪ2mol ���ⶨD��ƽ����Ӧ����Ϊ0.1mol/Lmin������˵���д������ �� ��
A.x = 2
B. B��ת����Ϊ20%
C. ƽ��ʱA��Ũ��Ϊ0.75mol/L
D. ���´�ƽ��ʱ������ѹǿΪ��ʼʱ��85%
���𰸡�D
��������D��ƽ����Ӧ����Ϊ0.1mol/Lmin��������D��0.1mol/Lmin��4L��5min��2mol�����ݱ仯��֮������Ӧ�Ļ�ѧ������֮�ȿ�֪��x��2��A��ȷ�����ݷ���ʽ��֪������A��B�����ʵ����ֱ���3mol��1mol������B��ת������![]() ��20����B��ȷ��ƽ��ʱA�����ʵ�����6mol��3mol��3mol����Ũ����
��20����B��ȷ��ƽ��ʱA�����ʵ�����6mol��3mol��3mol����Ũ����![]() ��C��ȷ����Ӧǰ������Dz���ģ����ѹǿҲ�Dz���ģ�D����ȷ����ѡD��
��C��ȷ����Ӧǰ������Dz���ģ����ѹǿҲ�Dz���ģ�D����ȷ����ѡD��


 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��пͭԭ���װ����ͼ��ʾ�����������ӽ���Ĥֻ���������Ӻ�ˮ����ͨ���������й�������ȷ����( )
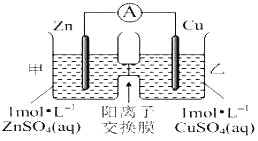
A. ͭ�缫�Ϸ���������Ӧ
B. ��ع���һ��ʱ��׳ص�C(SO42-)��С
C. ��ع���һ��ʱ����ҳ���Һ������������
D. ������ͨ������Ĥ�������ƶ���������ͨ������Ĥ���ƶ���������Һ�е��ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.���ˮ�еμ�FeCl3��Һ�Ʊ�Fe��OH��3���壺Fe3++3H2O ![]() Fe��OH��3��+3H+
Fe��OH��3��+3H+
B.��С�մ�����θ����ࣺNaHCO3��+H+=Na++CO2��+H2O
C.ʵ������Ũ������MnO2��Ӧ��Cl2��MnO2+4H++2Cl�� ![]() Cl2��+Mn2++2H2O
Cl2��+Mn2++2H2O
D.��FeCl3��Һ��ʴӡˢ��·�壺Fe3++Cu=Fe2++Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڷ�Ӧ��C+CO2��2CO�У���ʹ��Ӧ��������Ĵ�ʩ�� ( )
������ѹǿ �������¶� ��ͨ��CO2 ������̼���� �ݽ���ѹǿ
A���٢ڢ� B���ڢۢܢ� C���٢ڢۢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1mol�Ҵ�(���е�����18O���)��Ũ������ڲ������������������ַ�Ӧ������������ȷ����( )
A.ˮ�����к���18OB.���������к���18O
C.������ϵ�����ַ����ж�����18OD.����90g��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������У������ڻ�ѧ������
A.���Ӽ�������B.������C.���ۼ�D.���Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���ȷ����
A.FeƬͶ��Ũ�����У�Fe+2H+�� Fe2++H2��
B.��������Һ��������ռ���Һ�У�Al3++4OH���� AlO2��+ 2H2O
C.FeS����ϡ������Һ�У�S2��+2H+ ��H2S��
D.��AlCl3��Һ�м��������ˮ��Al3++4NH3��H2O�� AlO2��+4NH4++2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ݻ�Ϊ2L�����������ڼ���0.2molN2��0.6molH2����һ�������·������·�Ӧ�� ![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g)
NH3(g)
���÷�Ӧ��ƽ�ⳣ���ı���ʽ��:____________��
����Ӧ�а�����Ũ�ȵı仯�����ͼ��ʾ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v(H2)=________��
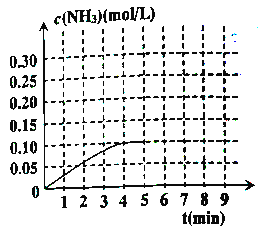
���жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_________��
a.N2��NH3Ũ����� b.NH3�ٷֺ������ֲ���
c.�����������ѹǿ���ֲ��� d.NH3������������H2�������������
e.�����л��������ܶȱ��ֲ���
����Ӧ��ƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ______��
a.0.2mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
���ڵ�5����ĩ�������������Сһ������ڵ�8����ĩ�ﵽ��ƽ������ʱNH3Ũ��ԼΪ0.25mol/L)��������ͼ�л����ӵ�5����ĩ��ʼ���ٴﵽ��ƽ��ʱNH3Ũ�ȱ仯���ߡ�______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����зǼ��Լ������ӻ������ǣ� ��
A. Na2O2 B. Na2O C. NaOH D. CaCl2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com