
【题目】在一容积为2L的密团容器内加入0.2molN2和0.6molH2,在一定条件下发生如下反应: ![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g)
NH3(g)
①该反应的平衡常数的表达式是:____________。
②反应中氨气的浓度的变化情况如图所示,计算从反应开始到平衡时,平均反应速率v(H2)=________。
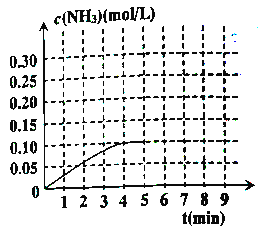
③判断该反应达到平衡状态的标志是_________。
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强保持不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
④反应达平衡后,第5分钟末,保持其它条件不变,仅改变反应温度,则NH3的物质的量浓度不可能为______。
a.0.2mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
⑤在第5分钟末,将容器体积缩小一半后,若在第8分钟末达到新平衡(此时NH3浓度约为0.25mol/L),请在上图中画出从第5分钟末开始,再达到新平衡时NH3浓度变化曲线。______________
【答案】  0.0375mol/(L·min) b c a c
0.0375mol/(L·min) b c a c 
【解析】①平衡常数可以用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积得到;该反应的平衡常数的表达式是: ;②△n(NH3)=0.1mol·L-1×2L=0.2mol
;②△n(NH3)=0.1mol·L-1×2L=0.2mol
N2+3H2![]() 2NH3
2NH3
n始/mol 0.2 0.6
n变/mol 0.1 0.3 0.2
n平/mol 0.1 0.3 0.2
v(H2)= ![]() = 0.0375mol/(L·min)
= 0.0375mol/(L·min)
③a.N2和NH3浓度相等,无法确定各组分的浓度是否改变,故不符;b.NH3百分含量保持不变,说明正逆反应速率相等,故相符;c.反应前后气体物质的量不相同,过程中和平衡状态下压强不变,容器内的压强不再变化,能说明反应达到平衡状态,故符合;d.NH3的生成速率与H2的消耗速率相等均为正确速率,故不符;e.容器中混合气体的密度保持不变,从开始到平衡始终不变。故不符;故选b c;(4)改变反应温度,平衡一定移动,而氮气和氢气不可能完全转化为氨气,所以c(NH3)<0.20mol·L-1,a. 如果氨气的浓度是0.20mol·L-1,则氮气与氢气完全转化,故错误;b.降低温度,氨气的浓度可能为0.12mol·L-1,故正确;c.温度改变,平衡一定移动,所以不可能为0.10mol·L-1,故错误;d.升高温度,平衡逆向移动,所以氨气浓度变小,可能为:0.08mol·L-1,故正确;故选:ac;⑤把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol·L-1,平衡后浓度约为0.3mol·L-1,所以第5分钟末到此平衡时NH3浓度的变化曲线为: 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是 ( )
A.铁水打花是一种古老的烟花,操作是“将生铁装进坩泥锅,并化成沸腾的铁汁”,其中坩泥锅的主要成分是硅酸盐
B.液氨可用作制冷剂是由于液氨汽化吸热
C.《梦溪笔谈》中“取精铁锻之百余火,…则纯钢也,虽百炼,不耗矣。”百炼钢熔点比纯铁高
D.华为最新一代旗舰芯片麒麟9905G中半导体材料为硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:
3A(气)+B(气) ![]() 2C(气)+。X D(气)经5min达到平衡,此时生成C为2mol ,测定D的平均反应速率为0.1mol/Lmin,下列说法中错误的是 ( )
2C(气)+。X D(气)经5min达到平衡,此时生成C为2mol ,测定D的平均反应速率为0.1mol/Lmin,下列说法中错误的是 ( )
A.x = 2
B. B的转化率为20%
C. 平衡时A的浓度为0.75mol/L
D. 恒温达平衡时容器内压强为开始时的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计方案中,可行的是
A.向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的![]()
B.加入过量CuCl2溶液,再过滤,除去Cu(NO3)2溶液中混有的AgNO3
C.先后滴加紫色石蕊试液、BaCl2溶液,可以将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开
D.某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A. 灼热的炭与CO2反应 B. Ba(OH)2·8H2O与NH4Cl反应
C. 铝片与稀H2SO4反应 D. 甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用密度为1.2g/mL、质量分数为36.5%的浓盐酸来配制90mL 0.8mol/L的稀盐酸.可供选择的仪器有:①玻璃棒 ②托盘天平 ③50mL烧杯 ④药匙 ⑤胶头滴管 ⑥量筒.
请回答下列问题:
(1)上述仪器中,在配制稀盐酸时需要使用的有(填序号),还缺少的仪器是(填仪器名称).
(2)计算:所需浓盐酸的物质的量浓度为 , 量取浓盐酸的体积为mL.量取浓盐酸时应选用量筒的规格为
①10mL ②50mL ③100mL
(3)将所配制的稀盐酸进行测定,发现浓度大于0.8mol/L.请你分析配制过程中可能引起浓度偏高的原因(答出两点)、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑.该反应中还原剂是 , 氧化剂是 .
(2)某班同学在玩密室逃脱游戏时,有一个密码锁,需要四个数字的密码开锁,一学生找到一张任务卡如图,则该密码为: 
(3)现有下列物质:①Cu ②HCl ③NH3 ④NaCl ⑤CaCO3 ⑥稀硫酸 ⑦NaHSO4 , 其中属于电解质,但熔融状态下并不导电的是(填序号),请写出NaHSO4在水溶液中的电离方程式
(4)写出制备Fe(OH)3胶体的化学方程式 , 向该胶体中逐滴加入稀硫酸的现象为 , 发生反应的离子方程式为
(5)在25℃,101kPa条件下,将15L O2通入10L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强.(1)若剩余气体的体积是15L,则通入10L CO和H2的混合气体中,V(CO)=L,V(H2)=L.若剩余气体的体积为a L,则a的取值范围是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是

A. a、c两元素的最高正价一定相等
B. d的原子序数不可能是b的原子序数的3倍
C. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物
D. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com