
【题目】配制50g质量分数5%的KNO3溶液,溶解过程KNO3的质量分数随时间变化关系如图所示,观察图象,分析形成这种结果的原因是
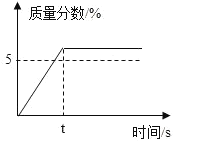
A.所用KNO3固体中含有水分B.量筒量水时俯视刻度线
C.KNO3固体溶解前所用烧杯内有水D.配好的溶液装瓶时部分液体洒落在试剂瓶外
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列根据实验操作和实验现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
B | 将Na2SO3样品溶于水,滴加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 原Na2SO3样品已变质 |
C | 向淀粉KI溶液中滴入3滴稀硫酸,再加入10%的H2O2溶液 | 滴入稀硫酸未见溶液变蓝;加入H2O2溶液后,溶液立即变蓝 | 酸性条件下,H2O2氧化性强于I2 |
D | 向5mL0.5mol/LNaHCO3溶液中滴入2mL1mol/LBaCl2溶液 | 产生白色沉淀,且有无色气体生成 | 反应的化学方程式为2NaHCO3+BaCl2=BaCO3↓+ 2NaCl+CO2↑+H2O |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛工厂TiCl4烟尘中含有大量的ScCl3、MgCl2及SiO2小颗粒等物质,某研究所利用上述烟尘回收Sc2O3,并制备钛白粉(TiO2),其工艺流程如图所示:
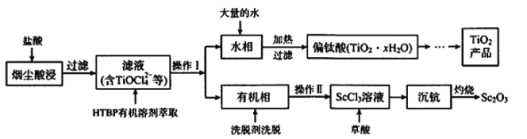
(1)在空气中灼烧草酸钪即可得到氧化钪(Sc2O3),其化学反应方程式为_____。
(2)“水相”的主要离子有TiOCl42-、H+、Cl-及Mg2+,写出加入大量的水并加热发生的相关离子反应方程式_____。
(3)酸浸过程中,稍过量的盐酸的作用除溶解吸收烟尘外,另外还有的作用是_______。
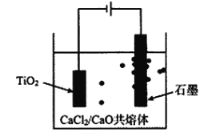
(4)钛的冶炼新法是剑桥电解法(如图)。以含少量CaCl2的CaO熔融物作为介质,电解时。在阴极生成的Ca进一步还原TiO2得钛。利用中学所学知识可以预测CaCl2的作用包含增强导电性及______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,2SO2(g)+O2(g)![]() 2SO3(g) △H= -197 kJ/mol。开始时在10 L的密闭容器中加入4.0 molSO2(g)和10.0 molO2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=_________,升高温度K将_____________(增大、减小或不变)。
2SO3(g) △H= -197 kJ/mol。开始时在10 L的密闭容器中加入4.0 molSO2(g)和10.0 molO2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=_________,升高温度K将_____________(增大、减小或不变)。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是__________________(填字母)。
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是__________________(填字母)。
A.恒温恒容,充入2mol SO3 B.恒温恒容,充入2mol N2
C.恒温恒压,充入1 mol SO3 D.升高温度
(3)在一密闭容器中进行下列反应:2SO2(g)+O2(g)![]() 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 ____________(填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 ____________(填字母)。

A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且乙的温度较低
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
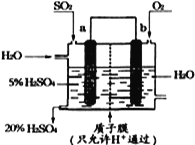
(4)某实验小组设想如右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:___________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:① 2SO2(g)+O2(g)![]() 2SO3(g)△H1= —197 kJ/mol;② H2O(g)=H2O(l)△H2= —44 kJ/mol;③ 2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3= —545 kJ/mol。写出SO3(g)与H2O(l)反应的热化学方程式是_____________________________。
2SO3(g)△H1= —197 kJ/mol;② H2O(g)=H2O(l)△H2= —44 kJ/mol;③ 2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3= —545 kJ/mol。写出SO3(g)与H2O(l)反应的热化学方程式是_____________________________。
(6)由硫酸可制得硫酸盐,在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,SO42-和CO32-的浓度之比___________________________。 (已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)= 5.2×10-9。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组的同学到化学实验室,用铝和氢氧化钠溶液反应来制备氢气。同学们取了3g纯铝片和40g一定质量分数的氢氧化钠溶液,充分反应后,铝片有剩余,称得反应后剩余物质的总质量为42.7g。试计算:
(1)生成氢气的质量是_____________g;
(2)所用氢氧化钠溶液的溶质质量分数_____________。
(提示:2Al+2NaOH+2H2O=2NaAlO2+3H2↑)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是中学化学中常用于混合物分离和提纯的装置:

请根据装置图回答下列问题:
(1)从氯化钾溶液中到氯化钾固体选择装置________(填代表装置图的字母,下同);除去粗盐中的泥沙,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,冷凝水流动的方向是____________________。
(4)在用装置B进行操作时,为使液体顺利滴下,应进行的具体操作是_____________。分液后漏斗内剩余的液体从分液漏斗的________(填“上口”或“下口”)倒入烧杯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁酸-3-苯丙酯(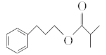 )是一种香料,下图是这种香料的一种合成路线:
)是一种香料,下图是这种香料的一种合成路线:
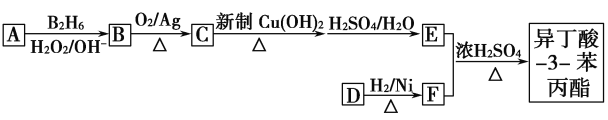
已知以下信息:
①有机物E的摩尔质量为88 g·mol-1,其核磁共振氢谱表明含有3种不同环境的氢原子。
②有机物F是苯甲醇的同系物。
③R—CH==CH2![]() R—CH2CH2OH。
R—CH2CH2OH。
请回答下列问题:
(1)异丁酸-3-苯丙酯的分子式为________________。
(2)A分子中的官能团名称为________________。
(3)C的结构简式为________________。
(4)一定条件下,1 mol D与2 mol H2能够完全反应生成F,D能够发生银镜反应,因此D生成F的反应类型为________________。
(5)E、F反应生成异丁酸-3-苯丙酯的化学方程式为________________________。
(6)已知有机化合物甲符合下列条件:
①与F是同分异构体;②苯环上有3个支链;③核磁共振氢谱显示其含有5种不同环境的氢原子,且不同环境的氢原子个数比为6∶2∶2∶1∶1;④与FeCl3溶液不能发生显色反应。
写出符合上述条件的有机物甲的结构简式:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com