
����Ŀ��ˮ�������ʳ��ˮ���ȼҵ��չ�����е���Ҫ��̱������Ƶü�Һ���ȸߡ������ö����ƣ�������ԭ��ʾ��ͼ���¡�����˵������ȷ����

A. ������������ĵ缫��ӦʽΪ2Cl����2e��===Cl2��
B. ����������3.36 L(��״��)����ʱ�����������NaOH������Ϊ12 g
C. ����в��������ĵ缫Ϊ����
D. ��ֱ���������£�������е�Na����ɽ����ƣ���ˮ���γ��ƹ��Ͻ𣬴Ӷ���Cl2�ֿ�
���𰸡�C
��������
A. ���������������ʧȥ���ӵ�������Ӧ���缫��ӦʽΪ2Cl����2e��=Cl2����A��ȷ��B. ����������3.36 L(��״��)���弴0.15mol����ʱ�����ݵ����غ㣬��������0.3molNa������Na�غ㣬���������0.3molNaOH��������Ϊ0.3mol��40g/mol=12 g��B��ȷ��C. ����У��ƹ��Ͻ���ʯī������ԭ��أ��ƹ��Ͻ�Ϊ������Naʧ���ӱ�������Na+��ʯī��Ϊ�������������������õ����ӱ���ԭ��������C����D. ����ʾ��ͼ����ֱ���������£�������������������ӵõ����ӱ���ԭ��Na��Na��ˮ���γ��ƹ��Ͻ𣬴Ӷ����������뿪����D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�±�Ϊ 25��ʱijЩ����ĵ���ƽ�ⳣ��������������Ϣ�ж�,����˵����ȷ����( )
| HClO |
|
|
|
|
A. ��NaClO��Һ��ͨ������������̼�����ӷ���ʽΪ:2ClO�� + CO2 + H2O�T2HClO + CO32��
B. ��ͬŨ�ȵ�CH3COONa��NaClO�Ļ����Һ��,c(CH3COOH) + c(HClO) �T c(OH��) �C c(H+)
C. 25��ʱ,0.1mol/LCH3COONa��Һ��ͨ��CO2����Һ��PH=7ʱ,��Һ��:c(Na+) �T c(CO32��) + c(HCO3��) + c(H2CO3)
D. ��0.1mol/LCH3COONa��Һ�м�������ˮ,��Һ�� c(CH3COO��)/c(CH3COOH).c(OH��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. Ŀǰ�ӵ�ʳ������Ҫ���ӵ���KIO3
B. �ճ������к�ҽԺ������ˮ�Ҵ�ɱ������
C. ��ɫʳƷ��ָ�����κλ�ѧ���ʵ�ʳƷ
D. �ڿ��������ձ���CO2�������ڿ�����Ⱦָ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�Ԥ����2020��ǰ���Լ������˿ռ�վ��Ϊ��ʵ�ֿռ�վ�����ŷţ�ѭ���������������CO2���ṩO2���ҹ���ѧ�������һ��װ��(����ͼ)��ʵ������̫����һ����һ��ѧ����ת�����ܷ�Ӧ����ʽΪ2CO2=2CO+O2 �����ڸ�װ�õ�����˵����ȷ����

A��ͼ��N�Ͱ뵼��Ϊ������P�Ͱ뵼��Ϊ����
B��ͼ�����ӽ���ĤΪ�����ӽ���Ĥ
C����Ӧ��ϣ���װ���е������Һ�ļ�����ǿ
D������������������X�缫�ķ�Ӧ��CO2+2e-+H2O=CO+2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mL 1.0 mol/L�����50 mL 1.1 mol/L ����������Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺

��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��________��
��2�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ__________(����ƫ��ƫС����Ӱ����)�������ڷ�Ӧ������Ϊ�з�������������������ڷ�Ӧ�лӷ������õ��к���____________(����ƫ��ƫС����Ӱ����)�����к��Ȳⶨʵ���д�����ˮϴ���¶ȼ��ϵ�����IJ��裬���˲������裬���õ��к��Ȼ�____________(����ƫ��������ƫС������������)��
��3�����õ�Ũ�ȵĴ�����NaOH��Һ��Ӧ�����õ��к��Ȼ�____________(����ƫ��������ƫС������������)����ԭ����_______________________________________________��
��4����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50 mL������¼��ԭʼ����(���±�)��
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�(t2)/�� | �²�(t2��t1)/�� | ||
���� | NaOH��Һ | ƽ��ֵ | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.00g/cm3���кͺ���Һ�ı�����c��4.18��10��3kJ/(g����)����÷�Ӧ���к���Ϊ��H��_______�����ݼ�������д�����кͷ�Ӧ���Ȼ�ѧ����ʽ______________________��
��5��ʵ���и���60 mL 1.0 mol��L-1�������50 mL 1.1mol��L-1��NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������_________�������������������������������к���__________ (��������������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����Cl2��H2��CO2��NO��NH3������ѡ��һ�����壬��������ʵ���ҿ�������ͼװ����ȡ���������ռ������Ժ�ˮ����������ȡ������Ļ�ѧ��Ӧ����ʽΪ_____________��

��2����֪��
��������װ����ȡ1,2 - �������飨��ɫҺ�壬�ܶ�2.18 g��cm-3���ۡ��е�Ϊ9.79�桢131.4�棬������ˮ�����Թ�d��װ��Һ��(���渲������ˮ)��

��eװ�õ�������____________�����۲쵽_________����ʱ���Թ�d�з�Ӧ����������
�����ñ�ˮ�����ձ��е���ˮ����������IJ���ȫ�����______________��
��ʵ�������Ҫ�����Թ�d�еĴֲ�Ʒ�������Ⱥ�˳����______�����ţ�
A.���� B.ˮϴ C.�ø�������� D.10%NaOH��Һϴ E.ˮϴ
��ʵ������40%��ϩ����Ħ������ΪM����Һ50g���Ƶò�Ʒm g������ϩ���ϳ�1,2 - ��������IJ���Ϊ_____________���ú�M��m�Ĵ���ʽ��ʾ����
�����ʵ��֤������Ӧ����ƿ�еĻ����Һ����Cl-��PO43-������ʵ�鷽������֪���Ȼ���������������ɫ�������ᱵ����ɫ����KSP�ֱ�Ϊ1.77��10-10��8.88��10-17 ��3.4��10��23��
��_____________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����ͷ�����ػ������ҩ�ﻯѧ������ѧ������Ӧ�ù㷺���ش���������:
��1����̬����ԭ�ӽṹʾ��ͼΪ____________________________��
��2��VO43-������ԭ�Ӽ۲�µ��Ӷ���ĿΪ______��һ��VO43-�����к���_______���Ҽ���
��3��2-�ϻ��������������(ͼ1) �Ǹ�����С����Ч����Ѫ�ǵ�����ҩ�
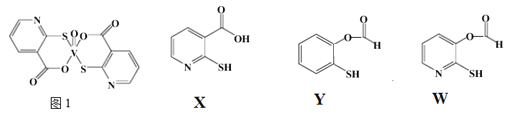
�ٸ�ҩ����Nԭ�ӵ��ӻ���ʽ��_______��
��X��Y��W����������ˮ�е��ܽ����ɴ�С��˳��Ϊ________��ԭ����__________��
��֪����ԭ�ӷ����У���ԭ�Ӷ���ͬһƽ��������Щԭ�����ƽ�е�p�������p���ӿ��ڶ��ԭ�Ӽ��˶����γɡ�����м��������м�������м�����![]()
![]() ��ʾ������m��n�ֱ���������γɴ�м���ԭ�Ӹ����͵��������籽�����д�м���ʾΪ
��ʾ������m��n�ֱ���������γɴ�м���ԭ�Ӹ����͵��������籽�����д�м���ʾΪ![]()
![]() ��
��
���������д��ڡ�����������_____��
A.O3 B.SO42- C.H2S D.NO3-
��CS2�����д�м����Ա�ʾΪ_______________��
��4��ƫ����識��ȷֽ�����������������������ˮ��ƫ����淋������ӳ�����ͼ2��ʾ��������״�ṹ����ƫ����淋Ļ�ѧʽΪ_________��
��5��ij���������ᄃ��ľ�����ͼ4��ʾ��![]() ��ʾV��
��ʾV��![]() ��ʾS�����þ����Ļ�ѧʽΪVS��ͼ3 Ϊ�þ����ĸ���ͼ��
��ʾS�����þ����Ļ�ѧʽΪVS��ͼ3 Ϊ�þ����ĸ���ͼ��
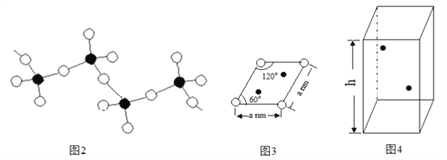
������ͼ4����![]() ���Vԭ�ӵ�λ�ã�
���Vԭ�ӵ�λ�ã�
����֪�������ܶ�Ϊdg/cm3 �����㾧������h =_____________cm��(�г�����ʽ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ������ͬһԭ�����͵���( )
A.Ũ�������ˮ����ɫ�Լ�ƿ����B.���ƺ��������ƹ��峤�ڱ�¶�ڿ����б���
C.SO2 �� Na2SO3 ��Һ����ʹ��ˮ��ɫD.���������Ͳ���������Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����̬������һ����̬ϩ����ɵĻ���ﹲ0.1 mol����ȫȼ�յ�0.16 mol������̼��3.6 gˮ������˵����ȷ������ ��
A. һ���м��� B. һ���Ǽ������ϩ C. ���������� D. һ������Ȳ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com