
【题目】(1)请从Cl2、H2、CO2、NO、NH3气体中选择一种气体,该气体在实验室可以用如图装置制取、净化、收集(可以含水蒸气),制取该气体的化学反应方程式为_____________;

(2)已知:
可用下述装置制取1,2 - 二溴乙烷(无色液体,密度2.18 g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。

①e装置的作用是____________;当观察到_________现象时,试管d中反应基本结束;
②若用冰水代替烧杯中的冷水,可能引起的不安全后果是______________;
③实验结束后,要精制试管d中的粗产品,操作先后顺序是______(填标号)
A.蒸镏 B.水洗 C.用干燥剂干燥 D.10%NaOH溶液洗 E.水洗
④实验消耗40%乙烯利(摩尔质量为M)溶液50g,制得产品m g,则乙烯利合成1,2 - 二溴乙烷的产率为_____________(用含M,m的代数式表示);
⑤设计实验证明,反应后烧瓶中的混合溶液含有Cl-、PO43-,简述实验方案。已知:氯化银、磷酸银(黄色)、磷酸钡(白色)的KSP分别为1.77×10-10、8.88×10-17 和3.4×10-23。
答:_____________________________________________________________________。
【答案】 CaCO3+2HCl=CaCl2+CO2↑+H2O 吸收溴蒸汽 试管内溶液褪为无色 d中长导管堵塞 BDECA或EDBCA ![]() 取适量混合溶液,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置,取上层清液于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-
取适量混合溶液,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置,取上层清液于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-
【解析】(1)按此装置,收集的气体的密度必须大于空气,H2、NH3的密度小于空气,不能用此装置收集;NO与空气中的氧气反应,不能用此装置收集;Cl2的制备需要加热装置;所以此装置只能用来制备和收集CO2,实验室制取CO2用稀盐酸和碳酸钙反应,制取该气体的化学反应方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O 答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O
(2)①d中的液溴易挥发,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收Br2蒸气,防止大气污染;d中乙烯与溴发生加成反应使液溴褪色,生成的1,2 - 二溴乙烷为无色,当观察到试管内溶液褪为无色时说明d中反应基本结束。②冰水的温度低于冷水,温度过低会使1,2 - 二溴乙烷凝结为固体,导致d中长导管堵塞,发生危险。③实验结束后,要精制试管d中的粗产品,将粗产品先用水洗涤,再用10%NaOH溶液和水洗涤,分离后加入无水氯化钙干燥,待溶液澄清后进行蒸馏,可以得到纯净的1,2 - 二溴乙烷。④乙烯利合成1,2 - 二溴乙烷的产率=![]() ⑤由已知条件可知氯化银、磷酸银(黄色)、磷酸钡(白色)都是沉淀,且磷酸钡比氯化银更难溶,所以应该先检验PO43-再检验Cl-,可设计实验如下:取适量混合溶液于试管中,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置一段时间,取上层清液少量于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-。答案为:① 吸收溴蒸汽 、试管内溶液褪为无色 ②d中长导管堵塞③ BDECA或EDBCA ④
⑤由已知条件可知氯化银、磷酸银(黄色)、磷酸钡(白色)都是沉淀,且磷酸钡比氯化银更难溶,所以应该先检验PO43-再检验Cl-,可设计实验如下:取适量混合溶液于试管中,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置一段时间,取上层清液少量于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-。答案为:① 吸收溴蒸汽 、试管内溶液褪为无色 ②d中长导管堵塞③ BDECA或EDBCA ④ ![]() ⑤取适量混合溶液,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置,取上层清液于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-
⑤取适量混合溶液,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置,取上层清液于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-


科目:高中化学 来源: 题型:
【题目】【加试题】六氨氯化镁 (MgCl2·6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组在实验室以菱镁矿(主 要成分 MgCO3,含少量 FeCO3等杂质)为原料制备六氨氯化镁,实验流程图如下:
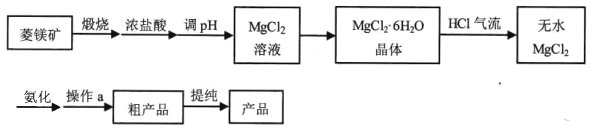
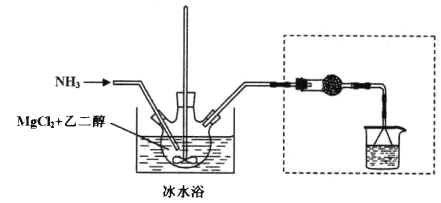
其中氨化过程装置示意图如下:
己知:(1)与Mg2+结合能力: H2O>NH3>HOCH2CH2OH>CH3OH
(2)相关物质的性质见下表:
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
请回答:
(1)调 pH适合的物质是________ (填化学式)。
(2)在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2,原因是________(用化学方程式表示)。
(3)虚框内装置的作用: _______,操作a的名称是_________。
(4)提纯操作中,下列洗涤剂最合适的是_______。
A.冰浓氨水 B.乙二醇和水的混合液
C.氨气饱和的甲醇溶液 D.氨气饱和的乙二醇溶液
(5)制得产品后,该科研小组对产品的成分进行测定,其中氯离子含量检测方法如下:
a.称取1.420g样品,加足量硫酸溶解,配制成250mL溶液;
b.量取25.00mL待测液于锥形瓶中;
c.用0.2000mol/LAgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液10.00mL。
① 配制样品溶液时加硫酸的原因___________。
② 该样品中氯离子百分含量为____________。
③ 将氯离子百分含量实验值与理论值 (36.04%)相比较,请分析造成此结果的可能原因有_________(己知滴定操作正确、硫酸根离子对检测无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如下。下列说法不正确的是

A. 电解器中阳极的电极反应式为2Cl--2e-===Cl2↑
B. 当阳极产生3.36 L(标准状况)气体时,解汞室中生成NaOH的质量为12 g
C. 解汞室中产生氢气的电极为阴极
D. 在直流电作用下,电解器中的Na+变成金属钠,与水银形成钠汞合金,从而与Cl2分开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 有一种有机物X,其结构简式为:HO—CH2CH=CH—COOH,试回答下列问题:
(1)X中的含氧官能团名称是_______________、_______________。
(2)向X中加入金属钠,将发生反应的化学方程式是_______________。
(3)如果在X中加入NaOH溶液,将发生反应的化学方程式是___________。
(4)下列关于X的说法中正确的是________________。
①X既能与酸发生酯化反应,又能与醇发生酯化反应
②X能够使溴水褪色,但不能使KMnO4酸性溶液褪色
③X能够发生缩聚反应,但不能发生加聚反应
II.分子式为C3H6O2的有机物有多种同分异构体,现有其中的四种X、Y、Z、W,它们的分子中均含甲基,将它们分别进行下列实验以鉴别,其实验记录如下:
NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
W | 水解反应 | 无现象 | 无现象 | 无现象 |
回答下列问题:
(1)写出X的结构简式________, W的系统命名是________.
(2)①Y在一定条件下发生分子内的脱水反应的化学方程式________________
②Z与NaOH溶液反应的化学方程式_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。

请回答下列问题:
(1)上述脱硫过程实现了________(填字母)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
D.获得金属单质
(2)已知:25 ℃、101 kPa时, Mn(s)+O2(g)===MnO2(s)ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是_____________________。
(3)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如图所示。

①a应与直流电源的________(填“正”或“负”)极相连。
②电解过程中氢离子的作用是____________________________;
③阳极的电极反应反应方程式为:______________若转移的电子数为6.02×1023,左室溶液中n(H+)的变化量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物X(C7H8O)与另一有机化合物Y发生如下反应生成化合Z(C11H14O2)
X+Y![]() Z+H2O
Z+H2O
(1)X是下列化合物之一,已知X不能与FeCl3溶液发生显色反应,则X是_________(填标号字母)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)Y的分子式是 _______,可能的结构简式是______________________和_______________________。
(3)Y有多种同分异构体,其中一种同分异构体E发生银镜反应后,其产物经酸化可得到F(C4H8O3),F可发生如下反应:F![]()
![]() +H2O,该反应的类型是________________,E的结构简式是__________________________。
+H2O,该反应的类型是________________,E的结构简式是__________________________。
(4)若Y与E具有相同的碳链,则Z的结构简式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,X、Y、Z、P分别为构成生物大分子的单体。请回答下列问题:

(1)Ⅰ在小麦种子中主要是指_______。A表示______,B表示______。染色体的主要成分是图中的_______(填符号)。
(2)Y和Z在化学组成上的区别是:Z特有的成分是_________。Ⅳ结构不同的原因从P分析是:________________________________________________。
(3)组成Ⅱ、Ⅲ的基本单位共有______种,碱基共有______种。由小分子物质X、Y、Z、P生成大分子物质Ⅰ、Ⅱ、Ⅲ、Ⅳ的过程中,有一共同的生成物是________。相同质量的脂肪氧化分解供能时释放的能量远远多于Ⅰ,原因是脂肪中________元素含量高。
(4)①鉴定花生子叶中存在脂肪的实验中,用苏丹III染液染色脂肪时,要用体积分数为50%的酒精溶液而不是蒸馏水洗去浮色,这是因为______。
②鉴定黄豆组织中存在蛋白质时,向组织样液中加入双缩脲试剂,其中双缩脲试剂B液的量只有4滴,而不能过量,为什么?______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com