
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。

请回答下列问题:
(1)上述脱硫过程实现了________(填字母)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
D.获得金属单质
(2)已知:25 ℃、101 kPa时, Mn(s)+O2(g)===MnO2(s)ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是_____________________。
(3)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如图所示。

①a应与直流电源的________(填“正”或“负”)极相连。
②电解过程中氢离子的作用是____________________________;
③阳极的电极反应反应方程式为:______________若转移的电子数为6.02×1023,左室溶液中n(H+)的变化量为________。
【答案】AC MnO2(s)+SO2(g)===MnSO4(s) ΔH=-248 kJ·mol-1 正 参与阴极反应 通过交换膜定向移动形成电流 Mn2+-2e-+ 2H2O == MnO2 + 4H+ 1 mol
【解析】
(1)脱硫能减少酸雨和废弃物再利用,白色污染的减少是塑料的减少和流程无关,最终得到的是金属的化合物,不是金属单质,故选AC。 (2) 25 ℃、101 kPa时,① Mn(s)+O2(g)===MnO2(s)ΔH=-520 kJ·mol-1,②S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1,③Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1,根据盖斯定律分析,③-②-①可得到MnO2(s)+SO2(g)===MnSO4(s) ΔH=-1065kJ/mol+520kJ/mol+297kJ/mol=-248 kJ·mol-1 (3). ①根据题意,锰离子失去电子生成二氧化锰,所以左室为阳极,则a为电源的正极。溶液中的氢离子向阴极移动,右室中氢离子得到电子生成氢气。 ②在电解过程中氢离子参与阴极反应 通过交换膜定向移动形成电流。③阳极是锰离子失去电子生成二氧化锰,电极反应为Mn2+-2e-+2H2O == MnO2+4H+。当转移的电子数为6.02×1023,即有1mol电子转移时,左室生成2molH+,但为了平衡电荷,左室溶液中有1 mol氢离子通过交换膜到右室。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知2C(s)+O2(g)=2CO(g) △H=—221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol1
C. 密闭容器中,0.3mol硫粉与0.2mol铁粉混合加热生成硫化亚铁0.2mol时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s) △H= - 95.6 kJ·mol1
D. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= —38.6kJ·mol1
2NH3(g) △H= —38.6kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2 。关于该装置的下列说法正确的是

A.图中N型半导体为正极,P型半导体为负极
B.图中离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的碱性增强
D.人体呼出的气体参与X电极的反应:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请从Cl2、H2、CO2、NO、NH3气体中选择一种气体,该气体在实验室可以用如图装置制取、净化、收集(可以含水蒸气),制取该气体的化学反应方程式为_____________;

(2)已知:
可用下述装置制取1,2 - 二溴乙烷(无色液体,密度2.18 g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。

①e装置的作用是____________;当观察到_________现象时,试管d中反应基本结束;
②若用冰水代替烧杯中的冷水,可能引起的不安全后果是______________;
③实验结束后,要精制试管d中的粗产品,操作先后顺序是______(填标号)
A.蒸镏 B.水洗 C.用干燥剂干燥 D.10%NaOH溶液洗 E.水洗
④实验消耗40%乙烯利(摩尔质量为M)溶液50g,制得产品m g,则乙烯利合成1,2 - 二溴乙烷的产率为_____________(用含M,m的代数式表示);
⑤设计实验证明,反应后烧瓶中的混合溶液含有Cl-、PO43-,简述实验方案。已知:氯化银、磷酸银(黄色)、磷酸钡(白色)的KSP分别为1.77×10-10、8.88×10-17 和3.4×10-23。
答:_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒的原子结构示意图为____________________________;
(2)VO43-的中心原子价层孤电子对数目为______,一个VO43-离子中含有_______个σ键;
(3)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
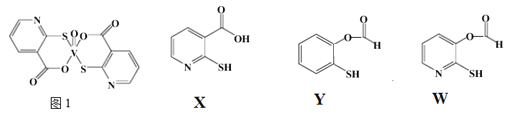
①该药物中N原子的杂化方式是_______;
②X、Y、W三种物质在水中的溶解性由大到小的顺序为________,原因是__________;
已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用![]()
![]() 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]()
![]() 。
。
③下列微粒中存在“离域Π键”的是_____;
A.O3 B.SO42- C.H2S D.NO3-
④CS2分子中大π键可以表示为_______________;
(4)偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈如下图2所示的无限链状结构,则偏钒酸铵的化学式为_________;
(5)某六方硫钒化合物晶体的晶胞如图4所示(![]() 表示V,
表示V,![]() 表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
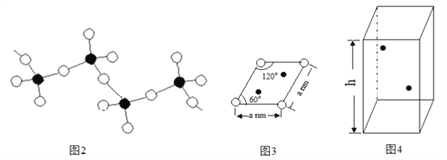
①请在图4中用![]() 标出V原子的位置;
标出V原子的位置;
②已知晶胞的密度为dg/cm3 ,计算晶胞参数h =_____________cm。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是____,铜的基态原子核外电子排布式为______ 。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为______________。
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:

图中虚线表示_____________,SO42-的立体构型是__________,NO3-中N原子的杂化轨道类型是___________;O原子的价电子排布图为__________________。
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为______。

(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如图)相似,该晶体储氢后的化学式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实不能用同一原理解释的是( )
A.浓硝酸和氯水用棕色试剂瓶保存B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.SO2 和 Na2SO3 溶液都能使氯水褪色D.常温下铁和铂都不溶于浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一-有机化学基础]在碱的作用下,两分子酯缩合形成β一羰基酯,同时失去一分子醇,该反应称克莱(R·L·Claisen)酯缩合反应,其反应机理如下: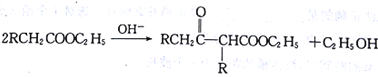 。利用Claisen反应制备化合物H的一种合成路线如下:
。利用Claisen反应制备化合物H的一种合成路线如下:
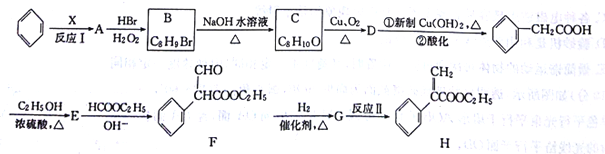
回答下列问题:
(1)反应Ⅰ的反应物和生成物的实验式均相同,则X的结构简式为_____,A的名称为____。
(2)F中含氟官能团的名称是_______;反应Ⅱ的反应类型是________。
(3)E![]() F反应的化学方程式为________。
F反应的化学方程式为________。
(4)B的含有苯环的同分异构体有____种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为__________、_________。
(5)乙酰乙酸乙酯是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线___________(无机试剂任进)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 加热使吸热反应速率加快,使放热反应速率减慢
B. 改变条件后若化学平衡向正向移动,则化学平衡常数变大
C. 当3v正(H2 )=2v逆(NH3)时,可逆反应N2+3H2![]() 2NH3 在向正反应方向进行
2NH3 在向正反应方向进行
D. 压缩装有NO2的注射器,容器内平衡2NO2![]() N2O4右移,最后气体颜色比原平衡深
N2O4右移,最后气体颜色比原平衡深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com