
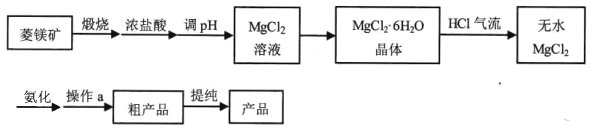
【题目】【加试题】六氨氯化镁 (MgCl2·6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组在实验室以菱镁矿(主 要成分 MgCO3,含少量 FeCO3等杂质)为原料制备六氨氯化镁,实验流程图如下:
其中氨化过程装置示意图如下:
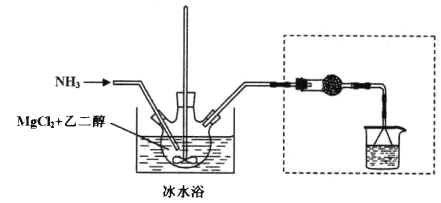
己知:(1)与Mg2+结合能力: H2O>NH3>HOCH2CH2OH>CH3OH
(2)相关物质的性质见下表:
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
请回答:
(1)调 pH适合的物质是________ (填化学式)。
(2)在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2,原因是________(用化学方程式表示)。
(3)虚框内装置的作用: _______,操作a的名称是_________。
(4)提纯操作中,下列洗涤剂最合适的是_______。
A.冰浓氨水 B.乙二醇和水的混合液
C.氨气饱和的甲醇溶液 D.氨气饱和的乙二醇溶液
(5)制得产品后,该科研小组对产品的成分进行测定,其中氯离子含量检测方法如下:
a.称取1.420g样品,加足量硫酸溶解,配制成250mL溶液;
b.量取25.00mL待测液于锥形瓶中;
c.用0.2000mol/LAgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液10.00mL。
① 配制样品溶液时加硫酸的原因___________。
② 该样品中氯离子百分含量为____________。
③ 将氯离子百分含量实验值与理论值 (36.04%)相比较,请分析造成此结果的可能原因有_________(己知滴定操作正确、硫酸根离子对检测无影响)。
【答案】 MgO MgC12+H2O![]() Mg(OH)Cl+HCl↑
Mg(OH)Cl+HCl↑![]() 吸收氨气,防止水蒸气进入三颈烧瓶中 过滤 C 避免 NH3与银离子络合,干扰检测 50.00% 氨化过程不完全或晶体称量时己有部分氨气逸出
吸收氨气,防止水蒸气进入三颈烧瓶中 过滤 C 避免 NH3与银离子络合,干扰检测 50.00% 氨化过程不完全或晶体称量时己有部分氨气逸出
【解析】(1)为了不引入新的杂质,调pH合适的物质为MgO,同时过量的MgO过虑即可除去;
(2)加热能促进Mg2+水解生成Mg(OH)Cl等,反应的方程式为MgC12+H2O![]() Mg(OH)Cl+HCl↑,所以在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2;
Mg(OH)Cl+HCl↑,所以在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2;
(3)倒置漏斗用于吸收剩余的氨气,干燥管用于防止水蒸气进入三颈瓶中;由于六氨氯化镁不溶于乙二醇,所以可用过滤的方法得到粗产品;
(4)根据甲醇沸点65℃和乙二醇的沸点197℃,产品在二者中都是难溶的,所以用氨气饱和的甲醇溶液洗涤粗产品,因甲醇和氨气都易挥发,更有利于提纯产品,因此正确答案为C;
(5)①检验Cl-需要用AgNO3,而Ag+能与NH3络合生成[Ag(NH3)2]+,所以加入硫酸除去NH3;②由实验数据可得n(AgNO3)=10.00×10-3L×0.2000mol·L-1=0.002000mol,所以Cl-的百分含量=![]() ×100%=50.00%;③根据MgCl2·6NH3的组成可得,其中Cl-的百分含量=
×100%=50.00%;③根据MgCl2·6NH3的组成可得,其中Cl-的百分含量=![]() ×100%=36.04%,但实验结果偏高,可能是MgCl2没有完全氨化,也可能是产品在称量时己有部分氨气逸出。
×100%=36.04%,但实验结果偏高,可能是MgCl2没有完全氨化,也可能是产品在称量时己有部分氨气逸出。


科目:高中化学 来源: 题型:
【题目】下列电离方程式中,不正确的是( )
A.HCl=H++Cl-B.Na2SO4=Na++ SO42
C.NaHCO3=Na++ HCO3-D.NaHSO4=Na++ SO42+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)除去自来水中的Cl - 等杂质选择装置 _____(填代表装置图的字母,下同)。
(2)从碘水中分离出I2 ,选择装置 _____,该分离方法的名称为 __________。
(3)装置A中②的名称是 _______,①进出水的方向是 ________________。使用A装置时常常要在②中加入沸石或者碎瓷片,目的是 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V mLAl2(SO4)3溶液中含有Al3+ a g,取![]() V mL溶液稀释到4V mL,则稀释后溶液中S042-的物质的量浓度是
V mL溶液稀释到4V mL,则稀释后溶液中S042-的物质的量浓度是
A. ![]() mol/L B.
mol/L B. ![]() mol/L
mol/L
C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下表为 25℃时某些弱酸的电离平衡常数,依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO— + CO2 + H2O═2HClO + CO32—
B. 相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH) + c(HClO) ═ c(OH—) – c(H+)
C. 25℃时,0.1mol/LCH3COONa溶液中通入CO2至溶液的PH=7时,溶液中:c(Na+) ═ c(CO32—) + c(HCO3—) + c(H2CO3)
D. 向0.1mol/LCH3COONa溶液中加入少量水,溶液中 c(CH3COO—)/c(CH3COOH).c(OH—)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知2C(s)+O2(g)=2CO(g) △H=—221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol1
C. 密闭容器中,0.3mol硫粉与0.2mol铁粉混合加热生成硫化亚铁0.2mol时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s) △H= - 95.6 kJ·mol1
D. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= —38.6kJ·mol1
2NH3(g) △H= —38.6kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多物质与身体健康有着密切关系,请结合所学知识,判断下列叙述中错误的是( )
A. 缺镁易患心血管病,缺碘易患甲状腺肿大
B. 在医疗上FeCl3常用作止血剂,ZnSO4常用作收敛剂
C. 葡萄糖、食盐、味精均可作食品添加剂
D. 苏丹红是一种呈红色的有机物,能当作辣椒红色素用于食品加工
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请从Cl2、H2、CO2、NO、NH3气体中选择一种气体,该气体在实验室可以用如图装置制取、净化、收集(可以含水蒸气),制取该气体的化学反应方程式为_____________;

(2)已知:
可用下述装置制取1,2 - 二溴乙烷(无色液体,密度2.18 g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。

①e装置的作用是____________;当观察到_________现象时,试管d中反应基本结束;
②若用冰水代替烧杯中的冷水,可能引起的不安全后果是______________;
③实验结束后,要精制试管d中的粗产品,操作先后顺序是______(填标号)
A.蒸镏 B.水洗 C.用干燥剂干燥 D.10%NaOH溶液洗 E.水洗
④实验消耗40%乙烯利(摩尔质量为M)溶液50g,制得产品m g,则乙烯利合成1,2 - 二溴乙烷的产率为_____________(用含M,m的代数式表示);
⑤设计实验证明,反应后烧瓶中的混合溶液含有Cl-、PO43-,简述实验方案。已知:氯化银、磷酸银(黄色)、磷酸钡(白色)的KSP分别为1.77×10-10、8.88×10-17 和3.4×10-23。
答:_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com