
【题目】V mLAl2(SO4)3溶液中含有Al3+ a g,取![]() V mL溶液稀释到4V mL,则稀释后溶液中S042-的物质的量浓度是
V mL溶液稀释到4V mL,则稀释后溶液中S042-的物质的量浓度是
A. ![]() mol/L B.
mol/L B. ![]() mol/L
mol/L
C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
【答案】C
【解析】
用公式n=![]() 计算VmLAl2(SO4)3溶液中n(Al3+),根据化学式计算VmLAl2(SO4)3溶液中n(SO42-),依据公式c=
计算VmLAl2(SO4)3溶液中n(Al3+),根据化学式计算VmLAl2(SO4)3溶液中n(SO42-),依据公式c=![]() 计算 VmLAl2(SO4)3溶液中c(SO42-);然后根据稀释前后SO42-物质的量不变列式计算稀释后c(SO42-)稀释。
计算 VmLAl2(SO4)3溶液中c(SO42-);然后根据稀释前后SO42-物质的量不变列式计算稀释后c(SO42-)稀释。
VmLAl2(SO4)3溶液中Al3+物质的量n(Al3+)=![]() mol,则VmLAl2(SO4)3溶液中n(SO42-)=
mol,则VmLAl2(SO4)3溶液中n(SO42-)=![]() mol×
mol×![]() =
=![]() mol,VmLAl2(SO4)3溶液中c(SO42-)=
mol,VmLAl2(SO4)3溶液中c(SO42-)=![]() mol÷(V×10-3)L=
mol÷(V×10-3)L=![]() mol/L;稀释前后SO42-物质的量不变,则
mol/L;稀释前后SO42-物质的量不变,则![]() mol/L×(
mol/L×(![]() V×10-3)L=c(SO42-)稀释×(4V×10-3)L,解得c(SO42-)稀释=
V×10-3)L=c(SO42-)稀释×(4V×10-3)L,解得c(SO42-)稀释=![]() mol/L,答案选C。
mol/L,答案选C。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】如图是用实验室制得的乙烯(C2H5OH![]() CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是

A. 装置①和装置③中都盛有水,其作用相同
B. 装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同
C. 产物可用分液的方法进行分离,1,2﹣二溴乙烷应从分液漏斗的上口倒出
D. 制备乙烯和生成1,2﹣二溴乙烷的反应类型分别是消去反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)![]() 2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是

A. x=1
B. 反应进行到1min时,反应体系达到化学平衡状态
C. 2min后,A的正反应速率一定等于C的逆反应速率
D. 2min后,容器中A与B的物质的量之比一定为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V L浓度为1.000 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是
A. 向原溶液中通入常温常压下的HCl气体22.4V L,使其完全溶解
B. 将溶液加热浓缩到0.5V L
C. 向原溶液中加入10.00 mol·L-1的盐酸0.2V L,再稀释至1.5V L
D. 向原溶液中加入V L 3 mol·L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是

A. 最高价氧化物对应水化物的酸性Y>Z>W
B. 含Y元素的盐溶液一定显酸性
C. 原子半径:rW>rZ>rY>rX
D. X与W的气态氢化物可相互反应生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】六氨氯化镁 (MgCl2·6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组在实验室以菱镁矿(主 要成分 MgCO3,含少量 FeCO3等杂质)为原料制备六氨氯化镁,实验流程图如下:
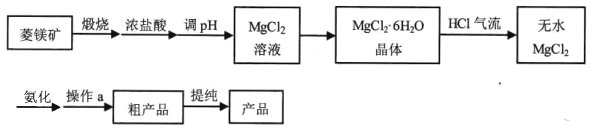
其中氨化过程装置示意图如下:
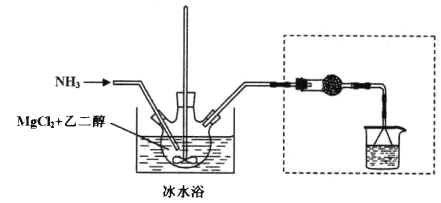
己知:(1)与Mg2+结合能力: H2O>NH3>HOCH2CH2OH>CH3OH
(2)相关物质的性质见下表:
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
请回答:
(1)调 pH适合的物质是________ (填化学式)。
(2)在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2,原因是________(用化学方程式表示)。
(3)虚框内装置的作用: _______,操作a的名称是_________。
(4)提纯操作中,下列洗涤剂最合适的是_______。
A.冰浓氨水 B.乙二醇和水的混合液
C.氨气饱和的甲醇溶液 D.氨气饱和的乙二醇溶液
(5)制得产品后,该科研小组对产品的成分进行测定,其中氯离子含量检测方法如下:
a.称取1.420g样品,加足量硫酸溶解,配制成250mL溶液;
b.量取25.00mL待测液于锥形瓶中;
c.用0.2000mol/LAgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液10.00mL。
① 配制样品溶液时加硫酸的原因___________。
② 该样品中氯离子百分含量为____________。
③ 将氯离子百分含量实验值与理论值 (36.04%)相比较,请分析造成此结果的可能原因有_________(己知滴定操作正确、硫酸根离子对检测无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )

A. N2(g)+3H2(g) = 2NH3(g) ;△H = 2(b—a) kJ/mol
B. N2(g)+3H2(g) = 2NH3(l);△H = 2(a—b—c) kJ/mol
C. ![]() N2(g)+
N2(g)+![]() H2(g) = NH3(l) ;△H = (b+c—a) kJ/mol
H2(g) = NH3(l) ;△H = (b+c—a) kJ/mol
D. ![]() N2(g)+
N2(g)+![]() H2(g) =NH3(g) ;△H = (a+b) kJ/mol
H2(g) =NH3(g) ;△H = (a+b) kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com