
分析 (1)Na2CO3、NaHCO3的物质的量之比为1:1,据此确定阴阳离子数目之比;
(2)加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,最终残留固体为Na2CO3,根据钠离子守恒计算最终Na2CO3的物质的量,再根据m=nM计算其质量;
(3)另一份与硫酸反应生成Na2SO4、二氧化碳与水,根据钠离子守恒2n(Na2SO4)=3n(Na2CO3•NaHCO3•2H2O),根据硫酸根守恒可知:n(H2SO4)=n(Na2SO4),进而计算硫酸的浓度.
解答 解:(1)Na2CO3、NaHCO3的物质的量之比为1:1,则阴阳离子数目之比为2:3,
故答案为:2:3;
(2)加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,最终残留固体为Na2CO3,每一份中Na2CO3•NaHCO3•2H2O的物质的量为$\frac{\frac{22.6g}{2}}{226g/mol}$=0.05mol,根据钠离子守恒最终Na2CO3的物质的量为$\frac{0.05mol×3}{2}$=0.075mol,故其质量为0.075mol×106g/mol=7.95g,
故答案为:7.95;
(3)另一份与硫酸反应生成Na2SO4、二氧化碳与水,根据钠离子守恒2n(Na2SO4)=3n(Na2CO3•NaHCO3•2H2O),则n(Na2SO4)=$\frac{3}{2}$×0.05mol=0.075mol,根据硫酸根守恒可知:n(H2SO4)=n(Na2SO4)=0.075mol,则硫酸的浓度为$\frac{0.075mol}{0.025L}$=3mol/L,
故答案为:3mol/L.
点评 本题考查混合物有关计算,侧重考查学生分析计算能力,注意利用守恒法计算解答.


科目:高中化学 来源: 题型:解答题
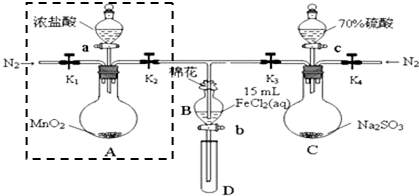
| 过程⑤B溶液中含有的离子 | 过程⑦B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡正向移动 | B. | 平衡逆向移动 | ||
| C. | 正逆反应速率都增大 | D. | NH3的质量分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl中含有35Cl | |
| B. | 生成物Cl2的平均相对分子质量为73.3 | |
| C. | 1molK35ClO3参加反应,失去电子数为5NA | |
| D. | 氧化剂和还原剂的物质的量之比1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯聚合为聚乙烯高分子材料符合绿色化学原子经济性要求 | |
| B. | 银制品久置干燥空气中因电化学腐蚀而使表面变暗 | |
| C. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| D. | 在合成洗涤剂中添加酶制剂可以提高洗涤效果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com