
【题目】有机物环丙叉环丙烷(![]() ),由于其特殊的电导结构一直受到理论化学家的注意,有关它的说法中错误的是( )
),由于其特殊的电导结构一直受到理论化学家的注意,有关它的说法中错误的是( )
A. 与氢气加成后的产物的一氯代物有2种
B. 它不可能是环丙烷(△)的同系物
C. 此有机物不能使酸性高锰酸钾溶液褪色
D. 它所有的原子均在同一平面上
【答案】CD
【解析】
A、环丙叉环丙烷的一氯取代物就是分子中的一个氢原子被氯原子代替后的产物;B、同系物属于同一类物质,分子组成上相差整数倍个-CH2-基团;C、分子中含有碳碳双键能使酸性高锰酸钾溶液褪色;D、环丙叉环丙烷中的碳原子和它相连的4个原子一定不共面.
A、环丙叉环丙烷分子中的4个“CH2”完全等同,分子中只有两种不同环境的氢,它的一氯代物有2种,选项A正确;B、环丙叉环丙烷分子的分子式是C6H8,与环丙烷C3H6不是同系物,选项B正确;C、根据结构图可知,环丙叉环丙烷分子中含有碳碳双键,能使酸性高锰酸钾溶液褪色,选项C错误;D、由于环丙烷的环并不是平面结构,所以分子中所有的原子不可能都在同一平面内,选项D错误。答案选CD。


科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不能用元素周期律解释的是
A. 酸性:H2SO4>H3PO4 B. 非金属性:Cl>Br
C. 碱性:NaOH>Mg(OH)2 D. 热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如下:
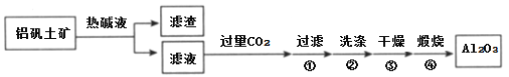
①滤液中通入过量CO2时主要反应的离子方程式是_______________________。
②煅烧生成氧化铝的化学方程式是 __________________________________。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以碳素材料为阴极,石墨棒为阳极,进行电解。
①下列关于Al2O3的说法正确的是________________(填序号)。
a. Al2O3属于电解质
b. Al2O3属于离子化合物
c. Al2O3属于碱性氧化物
d. Al2O3的熔点低,可作耐火材料
②阳极石墨棒需要不断补充,写出电极反应式并简述其原因:________________。
(3)高纯度氧化铝也可利用铵明矾分解制得:
①铵明矾晶体的化学式为NH4Al(SO4)212H2O,铵明矾属于__(填“纯净物”或“混合物”),在0.1mol/L铵明矾的水溶液中,浓度最大的离子是______,c(NH4+ ) ____c(Al3+)(填“=”“>”或“<”);
②铵明矾分解反应:6NH4Al(SO4)212H2O![]() 3Al2O3 + 2NH3 ↑+ 2N2 ↑+ 6SO2 ↑+ 6SO3 ↑+ 81H2O,请标出此反应电子转移的方向和数目______。
3Al2O3 + 2NH3 ↑+ 2N2 ↑+ 6SO2 ↑+ 6SO3 ↑+ 81H2O,请标出此反应电子转移的方向和数目______。
查看答案和解析>>
科目:高中化学 来源: 题型:
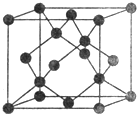
【题目】X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________;
(2)化合物X2W2中W的杂化方式为___________,ZW2-离子的立体构型是___________;
(3)Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机物的判断错误的是( )


A. 除①③外,其他有机物均可使酸性高锰酸钾溶液褪色
B. ③④⑥都属于芳香烃,④⑥苯环上的一溴代物的同分异构体数目均有6种
C. ②⑤的一氯代物均只有一种,①的一氯代物有四种,④苯环上的二氯代物有9种
D. ④⑤⑥的所有碳原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B都为短周期元素,且甲、乙、丙常温下都为气体(如图所示)。2 mol甲分子反应生成1 mol 丙和3 mol乙,下列对此判断不正确的是( )

A. 1个乙分子中含有2个A原子
B. 甲的摩尔质量为17 g·mol-1
C. 同温同压下,生成丙和乙的体积比为1∶3
D. 标准状况下,11.2 L甲溶于500 mL水中,所得溶液中甲的物质的量浓度为1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①~⑧在元素周期表的对应位置如图所示,用化学式或元素符号回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑦ | ① | ② | |||||
3 | ③ | ④ | ⑤ | ⑧ | ⑥ |
(1)元素⑧的原子结构示意图__________;
(2)请写出⑦的单质与⑧的最高价氧化物对应的水化物的浓溶液在加热条件下反应的化学方程式为:__。
(3)元素③的最高价氧化物对应的水化物中含有_____(填离子键、极性共价键或非极性共价键),该物质的电子式为________
(4)元素①的氢化物与其最高价氧化物所对的水化物反应的产物为______,该物质为_______(填离子化合物或共价化合物);一定条件下①的氢化物与⑥的单质混合,得到另一种单质和盐的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有IL1.0mol/L的氨水,下列关于该氨水的说法正确的是
A. NH3H2O的物质的量为1mol B. NH4+为1mol
C. NH3、NH3H2O、NH4+的物质的量之和为1mol D. NH3为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 一定温度下,反应MgCl2(1)= Mg(1)+Cl2(g)的 △H>0,△S>0
B. 常温下,NH4Cl溶液加水稀释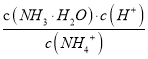 增大
增大
C. 电解饱和食盐水产生了11.2LH2,则反应中转移的电子数为6.02×1023
D. 在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com