
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
| A. | Z的氢化物的稳定性强于L的氢化物的稳定性 | |
| B. | Y与Q形成的化合物不能跟氢氧化钠溶液反应 | |
| C. | 等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多 | |
| D. | 在化学反应中,M原子与其他原子易形成共价键而不易形成离子键 |
分析 短周期主族元素中,元素最高化合价与其族序数相等,其最低化合价=族序数-8;原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中数据知,X位于第IIA族、Y位于第IIIA族、Z和Q位于第VIA族、L位于第VIIA族、M位于第IVA族,
根据原子半径大小知,X为Mg、Y为Al、Z为S、L为Cl、M为C、Q为O元素;
A.元素的非金属性越强,其氢化物的稳定性越强;
B.Y和Q形成的化合物是氧化铝,为两性氧化物;
C.等物质的量的X和Y分别与足量稀盐酸反应,生成氢气的物质的量与其转移电子数成正比;
D.在化学反应中,M为C元素,C元素易和其它元素形成共价键.
解答 解:短周期主族元素中,元素最高化合价与其族序数相等,其最低化合价=族序数-8;原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中数据知,X位于第IIA族、Y位于第IIIA族、Z和Q位于第VIA族、L位于第VIIA族、M位于第IVA族,
根据原子半径大小知,X为Mg、Y为Al、Z为S、L为Cl、M为C、Q为O元素;
A.元素的非金属性越强,其氢化物的稳定性越强,非金属性Z<L,所以Z的氢化物的稳定性弱于L的氢化物的稳定性,故A错误;
B.Y和Q形成的化合物是氧化铝,为两性氧化物,能溶于强碱溶液NaOH溶液,故B错误;
C.等物质的量的X和Y分别与足量稀盐酸反应,生成氢气的物质的量与其转移电子数成正比,铝失去电子物质的量大于Mg,所以铝生成的氢气大于镁,故C错误;
D.在化学反应中,M为C元素,C原子最外层有4个电子,不易失电子也不易得电子,所以C元素易和其它元素形成共价键,故D正确;
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断及对元素化合物性质结构的综合应用,明确原子结构、元素周期表结构及元素化合物性质是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
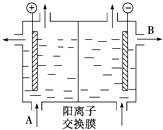 按要求完成下列各小题
按要求完成下列各小题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 | 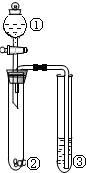 |
| A | 稀盐酸 | 石灰石 | 稀的碳酸钠溶液 | 溶解度:碳酸钠>碳酸氢钠 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸有脱水性、强氧化性 | |
| C | 浓硫酸 | Na2SO3 | 品红溶液 | 浓硫酸具有强氧化性 | |
| D | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 酸性:盐酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
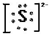
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电子式: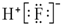 | |
| B. | H、D、T是氢元素的三种不同核素,互称同位素 | |
| C. | K+离子的结构示意图: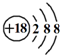 | |
| D. | 溴化钠的电子式: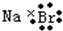 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
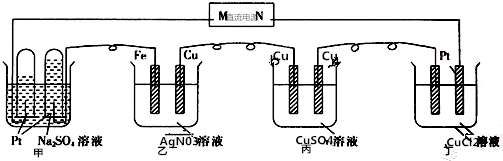
| A. | N为直流电源的正极 | |
| B. | 乙池的总反应为4AgN03+2H20═4Ag+4HNO3+O2↑ | |
| C. | 丙池的反应符合电解精炼铜原理 | |
| D. | 要使丁池电解质溶液复原,需加适量的CuCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com