
【题目】如图所示,△H1=﹣393.5kJmol﹣1,△H2=﹣395.4kJmol﹣1,下列说法或表示式正确的是( )
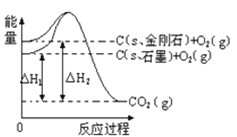
A.C(s、石墨)═C(s、金刚石)△H=﹣1.9 kJmol﹣1
B.石墨的稳定性强于金刚石
C.石墨和金刚石的转化是物理变化
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
【答案】B
【解析】
试题分析:由图得:①C(s,石墨)+O2(g)=CO2(g)△H=-393.5kJmol-1,②C(s,金刚石)+O2(g)=CO2(g)△H=-395.4kJmol-1,利用盖斯定律将①-②可得:C(s、石墨)═C(s、金刚石)△H=+1.9 kJmol﹣1。A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJmol-1,错误;B、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,正确;C、石墨转化为金刚石是化学变化,错误;D、依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJmol-1,1 mol石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;
X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则在X极附近观察到的实验现象是 ;Y电极上的电极反应式为 .若电解过程转移的电子为0.2mol,则X电极上产生的气体体积是 L(标准状况下).
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 ;Y电极的电极反应式为 .(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)△H=+57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是( )
2NO2(g)△H=+57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是( )

A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点气体的平均相对分子质量:a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开) 1mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能: P-P 198 kJ.mol-1、P-O 360 kJ.mol-1、氧气分子内氧原子间的键能为498 kJ.mol-1 。则P4+3O2 =P4O6的反应热H为
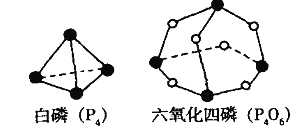
A.+1638 kJ.mol-1 B.-1638 kJ.mol-1
C.-126 kJ.mol-1 D.+126 kJ.mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像不能正确反映其对应操作中各量变化关系的是( )

A.高温煅烧一定质量的石灰石
B.在密闭容器内加热一定质量的铜粉
C.将一定质量的KNO3饱和溶液恒温蒸发水分
D.向一定质量部分变质的NaOH溶液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(27分)
(1)甲烷和氯气发生的一系列反应都是 ______反应,写出第一步反应的化学方程式 ____________________________________________。
(2)分子中含有34个氢原子的烷烃是 ______(填名称),乙烯的结构简式为_____________________,糖尿病患者尿液中含的糖类的分子式 。
(3)现有四种试剂:A.新制的Cu(OH)2;B.浓硝酸;C.AgNO3溶液;D.碘水。为了鉴别下列四瓶无色溶液,请你选择合适的试剂,将其填入相应的括号中。
①葡萄糖溶液( ) ②食盐溶液( )
③淀粉溶液( ) ④鸡蛋清溶液( )
(4)将下列各组金属与其对应的最佳冶炼方法用线连起来:
金属组 冶炼方法
Fe、Zn、Cu等中等活泼的金属 利用铝热反应原理用Al还原
Na、Mg、Al等活泼金属 以C、CO或 H2 作还原剂还原
Hg、Ag等不活泼金属 电解法
V、Cr、Mn、W等高熔点金属 热分解法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g)![]() H2(g)+CO2(g),反应过程中测定的部分数据见下表:
H2(g)+CO2(g),反应过程中测定的部分数据见下表:
反应时间/min | 0 | 2 | 4 | 6 |
n(CO)/mol | 1.20 | 0.90 | 0.80 | |
n(H2O)/mol | 0.60 | 0.20 |
(1)反应在2 min内的平均速率为v(H2O)=________。
(2)800 ℃时,化学平衡常数K的值为________。
(3)保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率________(填“增大”、“减小”或“不变”)。
(4)在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关SO2的说法中,不正确的是
A.溶于水能导电,属于电解质
B.使品红溶液褪色,有漂白性
C.使酸性高锰酸钾溶液褪色,有还原性
D.能杀菌、消毒,可按照国家标准用作食物的防腐剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com