
【题目】0.5mol某羧酸与足量乙醇发生酯化反应,生成酯的质量比原羧酸的质量增加了28g,则原羧酸可能是
A.甲酸 B.乙二酸 C.丙酸 D.丁酸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示,△H1=﹣393.5kJmol﹣1,△H2=﹣395.4kJmol﹣1,下列说法或表示式正确的是( )
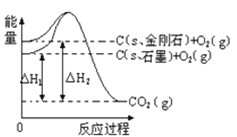
A.C(s、石墨)═C(s、金刚石)△H=﹣1.9 kJmol﹣1
B.石墨的稳定性强于金刚石
C.石墨和金刚石的转化是物理变化
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知下列反应的能量变化示意图如下,下列有关说法正确的是( )
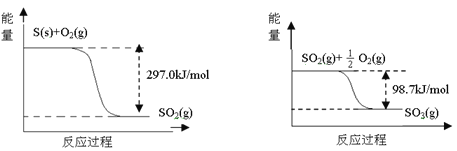
A.1molS(g)与O2(g)完全反应生成SO2(g),反应放出的热量<297.0kJ
B.在相同条件下,SO3(g)比SO2(g)稳定
C.1molSO2(g)和1/2molO2(g)生成1molSO3(l)放出98.7kJ的热量
D.由图得S(s)+3/2O2(g)![]() SO3(g) △H=-198.3kJ/mol
SO3(g) △H=-198.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的说法中错误的是
A.采煤矿井中的甲烷气体是植物残体经微生物发酵而来的
B.天然气的主要成分是甲烷
C.甲烷是没有颜色、没有气味的气体,极易溶于水
D.甲烷与氯气发生取代反应所生成的产物四氯甲烷是一种效率较高的灭火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)![]() 4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe + 4NaOH
4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe + 4NaOH![]() Fe3O4 + 2H2↑ + 4Na↑。下列有关说法正确的是( )
Fe3O4 + 2H2↑ + 4Na↑。下列有关说法正确的是( )

A. 电解熔融氢氧化钠制钠,阳极发生电解反应2OH--2e-===H2↑+O2↑
B. 盖·吕萨克法制钠原理是利用铁的还原性比钠强
C. 若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数不同
D. 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阴极,铁为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效减碳的手段之一是节能,下列制氢方法最节能的是 。
A.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O![]() CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L 的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
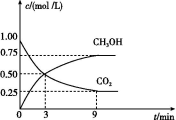
从3 min到9 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×1 | 2.4×1 | 1×1 |
下列说法正确的是 。
A.该反应正反应是放热反应
B.该反应在升高温度时,CH3OH(g)的体积分数减小,说明v正(CH3OH)减小,v逆(CH3OH)增大
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 Mpa)和250 ℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是( )
2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是( )
A.10到15秒内c(NH3) 增加量等于0.25mol L—1
B.10秒内氨气的平均反应速率为0.025molL—1·s—1
C.达平衡后,分离出少量NH3,v正 增大
D.该反应的逆反应的活化能不小于92.2kJmol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如表实验.
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验 内容 |
|
|
|
请回答:
①在一周的观察过程中,他发现实验序号为 的试管中铁钉锈蚀速度最慢..
②下列防止钢铁锈蚀的措施不合理的是 (填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由 腐蚀造成的.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面六个图中,横坐标为某溶液中加入某物质的量,纵坐标为生成沉淀的量。从A—F中选择符合表中各题要求的序号填入表中:
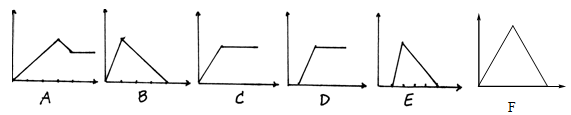
溶 液 | 加入的物质 | 答案序号 |
⑴饱和石灰水 | CO2 | |
⑵AlCl3溶液 | 过量NH3 | |
⑶含少量NaOH的NaAlO2 | 过量CO2 | |
⑷含少量NaOH的NaAlO2 | 逐滴加稀盐酸 | |
⑸MgCl2、AlCl3混合液 | 逐滴加NaOH至过量 | |
⑹NaOH溶液 | 逐滴加AlCl3至过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com