
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍。则下列判断正确的是
A.两种单质的摩尔质量比为1∶4 B.生成物C中A的质量分数为75%
C.生成物C中A、B的原子个数比为3∶1 D.反应前后气体分子数比为1∶4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)  2SO3(g)。反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是
2SO3(g)。反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
A.反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.10molSO3和0.010 molO2,到达平衡时,n(SO2)=0.012 mol
C.保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol·L-1,则反应的△H>0
D.相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率小于88%
查看答案和解析>>
科目:高中化学 来源: 题型:
可作为可逆反应 N2(g)+O2(g) 2NO(g)已达到平衡状态的标志的是( )
2NO(g)已达到平衡状态的标志的是( )
A.单位时间内每生成 n mol N2,同时生成2 n mol NO
B.容器内反应混合物的总压强不随时间改变
C.O2的消耗速率等于NO的消耗速率
D.容器内始终有N2、O2和NO共存
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种物质的转化关系如图所示。下列组合中不符合该关系的是( )
| A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | SO2 |
| Y | FeCl2 | NaOH | CO2 | Na2SO3 |
| Z | Cl2 | Na2CO3 | CaCO3 | H2SO4 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | NaHSO3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、AlO2-、Al3+、CO32-、NO3-七种离子中的几种,向该溶液中逐滴加入一定量1 mol·L-1 NaOH溶液 的过程中,开始没有沉淀,而后才有沉淀。则下列判断正确的是( )
的过程中,开始没有沉淀,而后才有沉淀。则下列判断正确的是( )
A.溶液中可能含有AlO2- B.溶液中可能含有NO3-
C.溶液中一定不含Fe2+和Fe3+ D.溶液中可能含有Fe3+,但一定不含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、N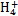 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C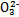 、S
、S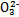 、S
、S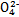 、Cl-、N
、Cl-、N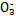 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
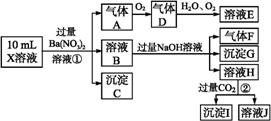
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ;不能确定是否含有的离子是 ,若要确定其中阳离子的存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:
步骤①中生成A 。
步骤②生成沉淀I 。
(4)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,当沉淀C物质的量(填:“<”或“=”或“>”某个值) mol,表明不能确定是否含有的离子中一定存在 。(若不止一种可能,填一种情况即可) 
查看答案和解析>>
科目:高中化学 来源: 题型:
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e- =Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
废物回收利用可实现资再生,并减少污染。如废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末,废旧玻璃也可回收再生。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4(ag)的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq) ====Cu2+(aq)+H2(g) ΔH=-64.39kJ·mol-1
2H2O2(l) ====2H2O (l)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ 1/2 O2(g) ==== H2O (l) ΔH=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O (l)的热化学方程式为
。
(3)氢氟酸是一种弱酸,可用刻蚀玻璃。已知25 ℃时:
HF(aq)+OH-(aq)===F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
则表示氢氟酸电离的热化学方程式为:
可见氢氟酸的电离是 的(填吸热或放热)。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁镍蓄电池又称爱迪生电池,放电时的总反应为: Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是 ( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-= Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com