
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)  2SO3(g)。反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是
2SO3(g)。反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
A.反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.10molSO3和0.010 molO2,到达平衡时,n(SO2)=0.012 mol
C.保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol·L-1,则反应的△H>0
D.相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率小于88%
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
胶体区别于其它分散系的本质特征是
A.胶体粒子直径在1-100nm之间 B. 胶体具有吸附性
C.胶体是一种介稳性的分散系 D. 光束通过胶体时有丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是
A.羟基的电子式: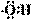
B.淀粉和纤维素的实验式:CH2O
C.CH4分子的球棍模型:
D.原子核内含有77个质子、115个中子的铱(Ir)原子:11577Ir
查看答案和解析>>
科目:高中化学 来源: 题型:
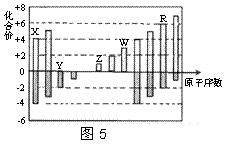
短周期元素X、Y、Z、W、R的化合价与原子序数的关系如图5所示。下列说法正确的是
A.原子半径:Z>Y>X
B.Z和Y形成的化合物是离子化合物
C.气态氢化物的稳定性:Y<R
D.常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
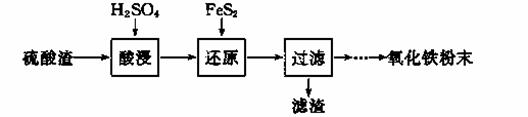
(1)“酸浸”中硫酸要适当过量,目的是 ▲ 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 ▲ 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定。有关反应的化学方程式如下:
2Fe3++Sn2++6Cl—=2Fe2++SnCl62—
Sn2++4Cl—+2HgCl2=SnCl62-+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
滴定时,K2Cr2O7标准溶液应盛放在 ▲ 滴定管中(填“酸式”、“碱式”);若不加HgCl2,则测定的Fe3+量 ▲ (填“偏高”、“偏低”或“不变”)。
(4)①可选用 ▲ (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 ▲ (用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀硝酸、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ▲ 。
b.沉淀: ▲ 。
c.分离,洗涤。
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于卤族元素由上到下性质递变的叙述,正确的是( )
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④ C.②④⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍。则下列判断正确的是
A.两种单质的摩尔质量比为1∶4 B.生成物C中A的质量分数为75%
C.生成物C中A、B的原子个数比为3∶1 D.反应前后气体分子数比为1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com