
科目:高中化学 来源: 题型:
无水AlCl3可用作有机合成的催化剂,食品膨松剂等。已知AlCl3、FeCl3分别在183℃、315℃时升华,无水AlCl3遇潮湿空气即产生大量白雾。
I.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
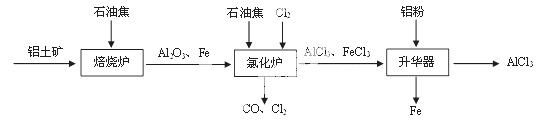
(1)焙烧炉中发生反应:①Fe2O3(s) +3C(s)  2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s)  2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
则反应②的平衡常数的表达式为K= ▲ 。
(2)氯化炉中Al2O3、Cl2和C在高温下发生反应的化学方程式为 ▲ ;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为 ▲ 。
(3)精制无水AlCl3的合格品中,AlCl3的质量分数不得低于96%。现称取16.25 g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。该样品中AlCl3的质量分数为 ▲ 。
II.实验室可用下列装置制备无水AlCl3。装置B、C中应盛放的试剂名称分别为 ▲ 、
▲ ,F中所盛放试剂的作用是 ▲ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)  2SO3(g)。反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是
2SO3(g)。反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
A.反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.10molSO3和0.010 molO2,到达平衡时,n(SO2)=0.012 mol
C.保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol·L-1,则反应的△H>0
D.相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率小于88%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素性质的递变情况错误的是
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素的最高正价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的金属性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
原电池的总反应的离子方程式是Zn+Cu2+===Zn2++Cu,该反应的原电池组成正确的是( )
| A | B | C | D | |
| 正极 | Zn | Cu | Ag | Cu |
| 负极 | Cu | Zn | Cu | Fe |
| 电解质溶液 | CuCl2 | CuSO4 | H2SO4 | ZnCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
可作为可逆反应 N2(g)+O2(g) 2NO(g)已达到平衡状态的标志的是( )
2NO(g)已达到平衡状态的标志的是( )
A.单位时间内每生成 n mol N2,同时生成2 n mol NO
B.容器内反应混合物的总压强不随时间改变
C.O2的消耗速率等于NO的消耗速率
D.容器内始终有N2、O2和NO共存
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种物质的转化关系如图所示。下列组合中不符合该关系的是( )
| A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | SO2 |
| Y | FeCl2 | NaOH | CO2 | Na2SO3 |
| Z | Cl2 | Na2CO3 | CaCO3 | H2SO4 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | NaHSO3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
废物回收利用可实现资再生,并减少污染。如废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末,废旧玻璃也可回收再生。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4(ag)的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq) ====Cu2+(aq)+H2(g) ΔH=-64.39kJ·mol-1
2H2O2(l) ====2H2O (l)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ 1/2 O2(g) ==== H2O (l) ΔH=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O (l)的热化学方程式为
。
(3)氢氟酸是一种弱酸,可用刻蚀玻璃。已知25 ℃时:
HF(aq)+OH-(aq)===F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
则表示氢氟酸电离的热化学方程式为:
可见氢氟酸的电离是 的(填吸热或放热)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com