
设NA为阿伏加德罗常数的数值,下列说法中正确的是
A.标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA。
B.常温下,pH=l的H2SO4溶液中含有的H+的数目为0.1NA。
C.标准状况下,2.24 L SO3中含有硫原子的数目为NA。
D.常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:填空题
【选修2—化学与技术】(14分)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。(1分)
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。

(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。

①阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:填空题
(16分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中的主要离子方程式为 。
 (2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
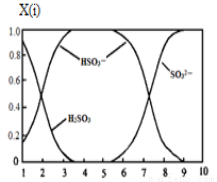
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程 式 , 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如图所示。①生成Ce4+从电解槽的 (填字母序号)口流出。②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)

查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是

A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是
A.硫酸铝溶液中加入过量氨水 Al3++3OH- ══Al(OH)3↓
B.电解饱和食盐水 2Cl- +2H2O H2↑+C12↑+2OH-
H2↑+C12↑+2OH-
C.NaAlO2溶液中通入过量的CO2 2AlO +CO2+3H2O===2Al(OH)3↓+CO
+CO2+3H2O===2Al(OH)3↓+CO
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2══Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有下列离子中的几种(不考虑溶液中微量的H+和OH-):Na+、NH 、SO
、SO 、CO
、CO 、NO
、NO 。取200 mL该溶液,等体积分成两份,分别做下列实验。
。取200 mL该溶液,等体积分成两份,分别做下列实验。
实验一:第一份加入足量烧碱并加热,产生的气体在标准状况下为224 mL。
实验二:第二份先加入足量的盐酸,无现象,再加入足量BaCl2溶液,得沉淀2.33 g。
A.该溶液可能含有Na+ B.该溶液一定含有NH 、SO
、SO 、CO
、CO 、NO
、NO
C.该溶液一定不含有NO D.该溶液一定含有Na+,且c(Na+)≥0.1 mol·L-1
D.该溶液一定含有Na+,且c(Na+)≥0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ•mol-1,自发进行的原因是
A. 是吸热反应 B. 是放热反应
C. 是熵减少的反应 D. 熵增大效应大于焓变效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度条件下,对于已达到平衡的反应:
FeCl3 +3KSCN  3KCl+Fe(SCN)3 ,在此溶液中作如下处理,平衡左移的是
3KCl+Fe(SCN)3 ,在此溶液中作如下处理,平衡左移的是
A.加入少量氯化钾固体 B.加入少量氯化铁固体
C.减少Fe(SCN)3的浓度 D.加水稀释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com