
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
|
电解质 |
电离方程式 |
电离常数K |
Ksp |
|
H2CO3 |
H2CO3 HCO3- |
K1=4.31×10-7 K2=5.61×10-11 |
- |
|
C6H5OH |
C6H5OH |
1.1×10-10 |
- |
|
H3PO4 |
H3PO4 H2PO4- HPO42- |
K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 |
- |
|
NH3·H2O |
NH3·H2O |
1.76×10-5 |
- |
|
BaSO4 |
BaSO4(s) |
- |
1.07×10-10 |
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:_________________。
(2)25℃时,向10 mL 0. 01 mol/LC6H5OH溶液中滴加V mL 0.1 mol/L氨水,混合溶液中粒子浓度关系正确的是__________(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01 mol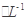 C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kb=____mol/L。
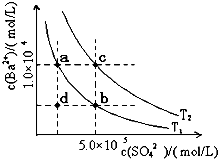
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
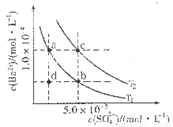
①T2____ 25℃(填“>”、“<”或“=”);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是____(填序号)。
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
(1)C6H5OH+PO33-=C6H5O-+HPO42-(2分) (2)b(2分) (3)1.78×10-4(2分)
(4)①>(2分) ②bc(全对得2分,只选一个且正确得1分,多选或错选的0分)
【解析】
试题分析:(1)弱酸的电离常数越大,酸性越强。根据电离平衡常数可知,苯酚的电离常数小于磷酸的第一步和第二步电离平衡常数,而大于磷酸的第三部电离平衡常数,所以依据较强酸制备较弱酸的原理可知C6H5OH与Na3PO4反应的离子方程式为C6H5OH+PO33-=C6H5O-+HPO42-。
(2)氨水的电离平衡常数大于苯酚的电离常数,所以C6H5O-的水解程度大于NH4+的水解程度。V=10时,二者恰好反应生成苯酚铵。由于C6H5O-的水解程度大于NH4+的水解程度,因此溶液显碱性。a、若混合液pH>7,则V不一定等于等于≥10,a不正确;b、V=5时,苯酚过量,所得溶液是苯酚铵和苯酚的混合液,且二者的浓度相等。所以根据物料守恒可知2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-),b正确;c、V=10时,二者恰好反应生成苯酚铵。由于C6H5O-的水解程度大于NH4+的水解程度,因此溶液显碱性。苯酚能电离出氢离子,抑制水的电离,所以混合液中水的电离程度大于0.01mol/LC6H5OH溶液中水的电离程度,c正确;d、若混合液pH<7,则苯酚一定是过量的,所以溶液中离子浓度大小顺序是c(C6H5O-)>c(NH4+)>c(H+)>c(OH-)或c(C6H5O-)>c(H+)>c(NH4+)>c(OH-),d不正确,答案选b。
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kb=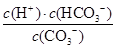 =
=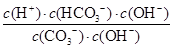 =
=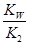 =
=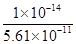 =1.78×10-4。
=1.78×10-4。
(4)①根据图像可知c点表示平衡点,此时溶度积常数=1.0×10-4×5.0×10-5=5.0×10-9>1.07×10-10。由于BaSO4的Ksp随温度升高而增大,所以温度T2>25℃。
②a.加入Na2SO4增大溶液中的SO42-浓度,可以使不溶液由a点变为b点,a不正确;b.在T1曲线上方区域(不含曲线)任意一点时,溶液中c(Ba2+)·c(SO42-)均大于T1温度下的溶度积常数,所以有BaSO4沉淀生成,b正确;c.d在曲线的下方,蒸发溶剂溶液中c(Ba2+)、c(SO42-)均增大,因此可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),c不正确;d.BaSO4的Ksp随温度升高而增大,所以升温不可能使溶液由b点变为d点,d不正确,bc。
考点:考查电离常数、溶度积常数、水解常数的应用、判断与计算


科目:高中化学 来源: 题型:阅读理解
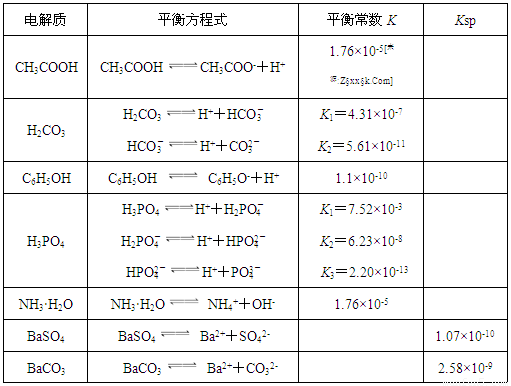
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- |
K1=4.31×10-7 K2=5.61×10-11 |
|
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
|
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4?Ba2++SO42- | 1.07×10-10 | |
| BaCO3 | BaCO3?Ba2++CO32- | 2.58×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为 (须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式: ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml0.01mol/L氨水,混合溶液中粒子浓度关系正确的是 ;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+)>c (C6H5O-) >c(H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2 c (NH4+)= c (C6H5O-)+c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式 。
(6)Ⅰ.如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
① T1 T2(填>、=、<),
T2温度时Ksp(BaSO4)= ;
② 讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理 次。[提示: BaSO4(s)+ CO32- (aq) BaCO3(s)+ SO42- (aq) ]
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省九校高三第二次联考理综化学试卷(解析版) 题型:填空题
(一) (1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
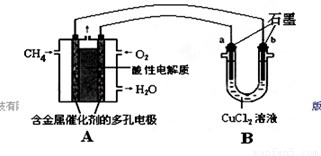
请回答:
①甲烷燃料电池的负极反应式是________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的
溶度积Ksp (25℃)。
|
电解质 |
平衡方程式 |
平衡常数K |
Ksp |
|
CH3COOH |
CH3COOH |
1.76×10-5 |
|
|
H2CO3 |
H2CO3 HCO3- |
K1=4.31×10-7 K2=5.61×10-11 |
|
|
C6H5OH |
C6H5OH |
1.1×10-10 |
|
|
H3PO4 |
H3PO4 H2PO4- HPO42- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
|
|
NH3·H2O |
NH3·H2O |
1.76×10-5 |
|
|
BaSO4 |
BaSO4 |
|
1.07×10-10 |
|
BaCO3 |
BaCO3 |
|
2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4- 均可看作酸,则它们酸性由强到弱的顺序为__________________________(填编号);
(2)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+);(填“>”、“=”或“<”)
(3)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是( );
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
(4)如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
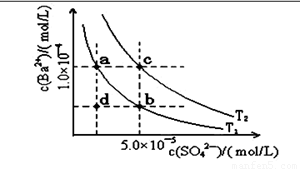
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时, 均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、 b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省台州市高三上学期期末质量评估化学试卷 题型:填空题
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为 (须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式: ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是 ;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式 。
(6)Ⅰ.如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
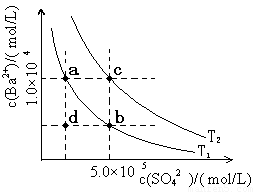
① T1 T2(填>、=、<),
T2温度时Ksp(BaSO4)= ;
② 讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理 次。[提示: BaSO4(s)+ CO32- (aq) BaCO3(s)+ SO42- (aq) ]
BaCO3(s)+ SO42- (aq) ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com