
【题目】Licht等科学家设计的Al—MnO4—电池原理如图所示,电池总反应为Al+MnO4—===AlO2—+MnO2,下列说法正确的是( )
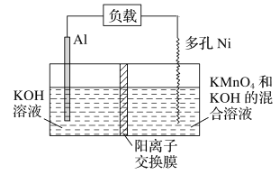
A. 电池工作时,K+向负极区移动
B. Al电极发生还原反应
C. 正极的电极反应式为MnO4—+4H++3e-===MnO2+2H2O
D. 理论上电路中每通过1mol电子,负极质量减小9g
【答案】D
【解析】
该电池的负极是Al,Ni是正极,在正极上发生得电子的还原反应,即MnO+2H2O+3e-===MnO2+4OH-,负极上金属铝失电子发生氧化反应,即Al-3e-+4OH-=Al(OH)4-,电池工作时,阳离子向正极移动,阴离子向负极移动,以此解答该题。
A.电池工作时,阳离子向正极移动,即K+向正极移动,故A错误;
B.反应中铝为为负极,发生还原反应,故B错误;
C.电解质呈碱性,MnO在正极上发生得电子的还原反应,即MnO+2H2O+3e-===MnO2+4OH-,故C错误;
D.理论上电路中每通过1mol电子,则有![]() mol铝被氧化,负极质量减少9g,所以D选项是正确的。
mol铝被氧化,负极质量减少9g,所以D选项是正确的。
所以D选项是正确的。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】已知: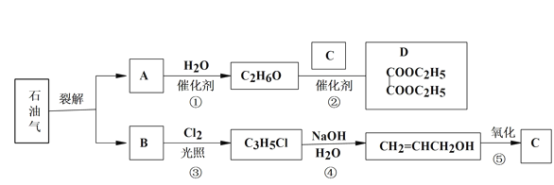
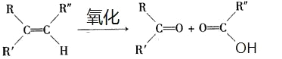
(1)B 和 A 为同系物,B 的结构简式为_____,其含有的官能团名称为_____。
(2)反应①的化学方程式为_____,其反应类型为_____。
(3)写出检验 C3H5Cl 中含有 Cl 原子的方法_____。
(4)C 的结构简式为________。
(5)反应④的化学方程式为________。
(6) 设计一条由乙烯为原料制备 D 的合成路线(其他无机原料任选)。合成路线流程图示例如下:_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2和SO3两种气体的混合物通入BaCl2溶液,其结果是( )
A. 两种气体都被吸收,并有BaSO4沉淀生成
B. 只生成BaSO3沉淀,SO3从溶液中逸出
C. 生成BaSO3和BaSO4两种沉淀
D. 只有BaSO4沉淀,SO2通入溶液中无沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之向的关系如图所示。则下列说法正确的是( )
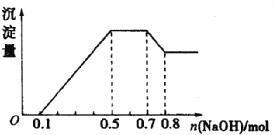
A. 溶液中的阳离子一定含有H+、Mg2+、Al3+,可能含有Fe3+
B. 溶液中c(NH4+)=0.2mol/L
C. 溶液中一定不含CO32-和NO3-,一定含有SO42-
D. c(H+):c(Al3+):c(Mg2+)=1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的说法中正确的是( )
A.氧化还原反应过程中一定有电子转移
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+→Fe2+的变化过程失去电子
D.失去电子的反应是还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验某固体物质中是否铵盐,你认为下列试纸或试剂一定用不到的是( )
①蒸馏水 ②氢氧化钠溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
A.①⑤B.④⑤C.①③D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是( )
A. 若XY2是共价化合物,则X与Y的原子序数可能相差1
B. 若XY2是离子化合物,则X与Y的原子序数可能相差8
C. 若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小
D. 若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com