
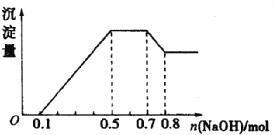
【题目】溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之向的关系如图所示。则下列说法正确的是( )
A. 溶液中的阳离子一定含有H+、Mg2+、Al3+,可能含有Fe3+
B. 溶液中c(NH4+)=0.2mol/L
C. 溶液中一定不含CO32-和NO3-,一定含有SO42-
D. c(H+):c(Al3+):c(Mg2+)=1:1:1
【答案】C
【解析】
①加入锌粒,产生无色无味的气体,生成气体是氢气,溶液显酸性,则CO32-和NO3-不能大量共存;②加入NaOH溶液,产生白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必然存在阴离子,则一定含有SO42-,结合图象中各阶段消耗的氢氧化钠,计算溶液中阳离子的物质的量,据此进行解答。
①加入锌粒,产生无色无味的气体,生成气体是氢气,溶液显酸性,则CO32-和NO3-不能大量共存;②加入NaOH溶液,产生白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必然存在阴离子,则一定含有SO42-,由图象可知,0~0.1段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1mol,则n(H+)=0.1mol;0.5~0.7段为铵根离子与氢氧化钠反应,消耗氢氧化钠为:0.7mol-0.5mol=0.2mol,则n(NH4+)=0.2mol;0.7~0.8段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol-0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知:n(Al3+)=0.1mol;0.1~0.5段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为:0.5mol-0.1mol=0.4mol,则n(Mg2+)=0.5×(0.4mol-0.1mol×3)=0.05mol,则
A.由上述分析可知,溶液中的阳离子只有H+、Mg2+、Al3+、NH4+,一定没有Fe3+,A错误;
B.溶液中n(NH4+)=0.2mol,缺少溶液体积,无法计算铵根浓度,B错误;
C.由分析可知,溶液中一定不含CO32-和NO3-,一定含有SO42-,C正确;
D.由上述分析可知,溶液中c(H+):c(Al3+):c(Mg2+)=0.1:0.1:0.05=2:2:1,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:

下列说法不正确的是
A. 聚氯乙烯的单体可由乙烯与HCl加成而得
B. 上述反应中①属于消去反应,④属于(脱氢)氧化反应
C. 火灾中由聚氯乙烯产生的有害气体中含HCl、CO、C6H6等
D. 在火灾现场,可以用湿毛巾捂住口鼻,并弯下腰尽快远离现场
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取O2。下列有关说法不正确的是
①光催化分解水制氧气:2H2O(l)=2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l) + O2(g) ΔH2=-196.4 kJ·mol-1
③一氧化氮分解制氧气:2NO(g)=N2(g) + O2(g) ΔH3=-180.5 kJ·mol-1
A. 反应①是人们获取H2的途径之一
B. 反应②、③都是化学能转化为热能
C. 反应H2O2(l)=H2O(g)+ ![]() O2(g)的ΔH=-98.2 kJ·mol-1
O2(g)的ΔH=-98.2 kJ·mol-1
D. 反应2H2(g)+2NO(g)=N2(g)+2H2O(l)的ΔH=-752.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) / mol | 0 | 0.16 | 0.19 | 0. 20 | 0.20 |
下列说法正确的是( )
A. 反应在前2 s 的平均速率v(CO)=0.080mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Cl2) =0.11mol·L-1,则反应的ΔH<0
C. T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,达到平衡前v正>v逆
D. T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Licht等科学家设计的Al—MnO4—电池原理如图所示,电池总反应为Al+MnO4—===AlO2—+MnO2,下列说法正确的是( )
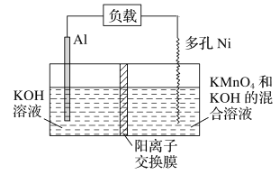
A. 电池工作时,K+向负极区移动
B. Al电极发生还原反应
C. 正极的电极反应式为MnO4—+4H++3e-===MnO2+2H2O
D. 理论上电路中每通过1mol电子,负极质量减小9g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向浓度均为0.10mol/L、体积均为1mL的NaOH溶液和Na2CO3溶液中分别加水,均稀释至VmL,两种溶液的pH与lgV的变化关系如图所示。下列叙述中错误的是
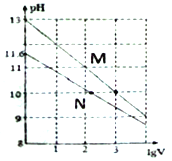
A. Ka1(CO32-)(Ka1为第一级水解平衡常数)的数量级为10-4
B. 曲线N表示Na2CO3溶液的pH随lgV的变化关系
C. Na2CO3溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D. 若将Na2CO3溶液加热蒸干,由于CO32-水解,最终析出的是NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如下图所示。下列说法正确的是
A.  图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.  图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.  图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 
 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在粗硅的制取中发生2C+SiO2![]() 2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
B. 盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D. 由Na2CO3+SiO2![]() Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com