
【题目】通过以下反应均可获取O2。下列有关说法不正确的是
①光催化分解水制氧气:2H2O(l)=2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l) + O2(g) ΔH2=-196.4 kJ·mol-1
③一氧化氮分解制氧气:2NO(g)=N2(g) + O2(g) ΔH3=-180.5 kJ·mol-1
A. 反应①是人们获取H2的途径之一
B. 反应②、③都是化学能转化为热能
C. 反应H2O2(l)=H2O(g)+ ![]() O2(g)的ΔH=-98.2 kJ·mol-1
O2(g)的ΔH=-98.2 kJ·mol-1
D. 反应2H2(g)+2NO(g)=N2(g)+2H2O(l)的ΔH=-752.1 kJ·mol-1
【答案】C
【解析】
反应①是制取氢气的途径径之一,A正确;②过氧化氢分解制氧气:2H2O2(l)=2H2O(l) + O2(g) ΔH2=-196.4 kJ·mol-1③一氧化氮分解制氧气:2NO(g)=N2(g) + O2(g) ΔH3=-180.5 kJ·mol-1都是放热反应,故反应②、③都是化学能转化为热能,B正确;根据盖斯定律,结合①②可知反应H2O2(l)=H2O(g)+ ![]() O2(g)的ΔH= +187,6kJ·mol-1故C错;根据盖斯定律,由③-①可得反应:2H2(g)+2NO(g)= N2(g)+2H2O(l) ΔH=ΔH3-ΔH1= -752.1 kJ·mol-1故D正确;本题正确答反应案;C。
O2(g)的ΔH= +187,6kJ·mol-1故C错;根据盖斯定律,由③-①可得反应:2H2(g)+2NO(g)= N2(g)+2H2O(l) ΔH=ΔH3-ΔH1= -752.1 kJ·mol-1故D正确;本题正确答反应案;C。


科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
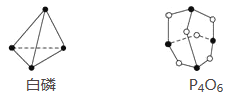
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃的锌锰干电池对环境污染很大,工业上可用如下工艺回收正极材料中的金属(部分条件未给出):
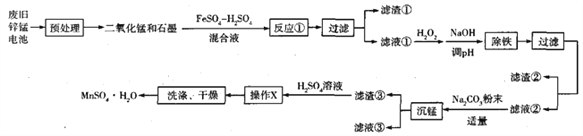
(1)废弃的锌锰干电池对环境的主要危害是__________, ![]() 中
中![]() 的化合价为__________。
的化合价为__________。
(2)锌锰干电池中氯化铵为电解质,其电子式为______________________________。
(3)反应①中氧化剂与还原剂的物质的量之比为______________________________。
(4)该工艺流程中多次用到过滤,实验室中过滤所需要的玻璃仪器有__________。
(5)已知:25℃时, ![]() ,滤液①中加入NaOH溶液至pH=_________时,
,滤液①中加入NaOH溶液至pH=_________时, ![]() 沉淀完全
沉淀完全![]() 时,认为
时,认为![]() 沉淀完全]。
沉淀完全]。
(6)写出“沉锰”过程中生成碱式碳酸锰![]() 的离子方程式为:______________________________________________________________________。
的离子方程式为:______________________________________________________________________。
(7)用硫酸酸化的![]() 浆液可吸收工业废气中的
浆液可吸收工业废气中的![]() 生成
生成![]() ,已知浆液中
,已知浆液中![]() 含量为
含量为![]() ,工业废气中
,工业废气中![]() 含量为
含量为![]() ,
, ![]() 的吸收率可达90%,则处理1000
的吸收率可达90%,则处理1000![]() 工业尾气,可得到
工业尾气,可得到![]() 的质量为__________kg(用含字母的代数式表示)。
的质量为__________kg(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A. v正(X)=v逆(Z)
B. 容器内压强不随时间变化
C. 容器内X、Y、Z的浓度之比为l:2:2
D. 单位时间内消耗0.1 mol X的同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入
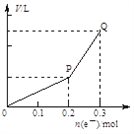
A. 0.1 mol CuO B. 0.05 mol Cu2(OH)2CO3
C. 0.1 mol Cu(OH)2 D. 0.1 mol CuCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_______________________________________。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为_____________________。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______________mol·L-1(填精确计算结果)。
(5) 将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个隔热恒容的密闭容器中进行下列两个可逆反应:甲中:C(s)+H2O(g) ![]() CO(g)+H2(g);乙中:CO(g)+H2O(g)
CO(g)+H2(g);乙中:CO(g)+H2O(g) ![]() CO2(g)+H2(g)。现有下列状态:①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变 ③各气体组分浓度相等 ④反应体系中温度保持不变 ⑤断裂氢氧键反应速率等于断裂氢氢键反应速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水的质量与生成氢气的质量之比为9∶1 ⑧同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明甲、乙容器中反应都达到平衡状态的是
CO2(g)+H2(g)。现有下列状态:①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变 ③各气体组分浓度相等 ④反应体系中温度保持不变 ⑤断裂氢氧键反应速率等于断裂氢氢键反应速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水的质量与生成氢气的质量之比为9∶1 ⑧同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明甲、乙容器中反应都达到平衡状态的是
A. ④⑤⑧ B. ③④⑥ C. ⑥⑦⑧ D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用HCl气体“置换”除水,升华相结合的方法从市售的氯化锌制备高纯度无水氯化锌,装置如图所示[市售氯化锌含Zn(OH)Cl]。下列说法不正确的是

A. 恒压漏斗的作用是平衡气体压强
B. 管式炉Ⅰ采取的升温方式是阶段式升温
C. 实验时,应先撒去管式炉Ⅰ,再撤去管式炉Ⅱ
D. 在尾气吸收装置前应增加一个干燥装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com