
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
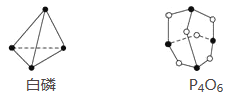
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
【答案】B
【解析】反应热△H=反应物总键能-生成物总键能,所以反应P4(白磷)+3O2=P4O6的反应热△H=6×198kJmol-1+3×498kJmol-1-12×360kJmol-1=-1638kJmol-1,答案选B。
点晴:本题主要是考查化学反应中能量的变化及反应热计算。明确反应热的计算方法是解答的关键。反应热的计算常用方法有:(1)根据热化学方程式计算:反应热与反应物各物质的物质的量成正比。(2)根据反应物和生成物的总能量计算:ΔH=E生成物-E反应物。(3)依据反应物化学键断裂与生成物化学键形成过程中的能量变化计算:ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量。(4)根据盖斯定律的计算,解答时注意灵活应用。


科目:高中化学 来源: 题型:
【题目】下列仪器在使用之前需要检查是否漏液的是( )
①分液漏斗 ②长颈漏斗 ③容量瓶 ④蒸馏烧瓶 ⑤洗气瓶.
A. ①②③ B. ①③ C. ①③⑤ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜(甲醚具有可燃性,是一种常用的燃料).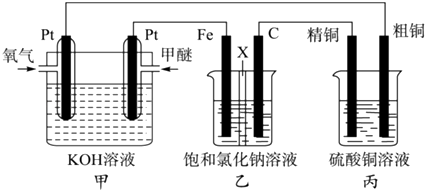
根据要求回答相关问题
(1)装置甲中通入燃料甲醚的一极是(填“正极”或“负极”),写出正极的电极反应式:
(2)装置乙中Fe为极(填“阳极”或“阴极”),石墨电极(C)的电极反应式为: .
(3)如果粗铜中含有锌、银等杂质,丙装置的阳极泥中含有 , 反应一段时间后,硫酸铜溶液浓度将(填“增大”、“减小”或“不变”.)
(4)当装置甲中消耗0.05molO2时,装置乙中溶液的pH为(溶液体积为200mL不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向偏铝酸钠溶液中逐滴加入盐酸,溶被的pH值随着加入盐酸体积的变化曲线如图所示,则下列说法正确的是
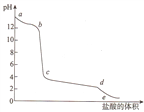
A. a~b段的主要离子方程式为A102-+4H+=Al3++2H2O
B. 向c点溶液中滴加氨水,发生的离子方程式为A13++30H-=Al(OH)3↓
C. c~d段的主要离子方程式为Al(OH)3+3H+= A13++3H2O
D. 向c点溶液中加入碳酸钠,发生的离子方程式为2 A13++CO32-+3H2O =2Al(OH)3↓+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源.通过电解法制备酒石酸(C4H606,简写为RH2)的原理如图所示(A、B为惰性电极,a、b为离子交换膜)
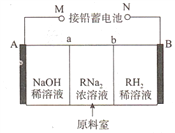
下列叙述不正确的是
A. N极的电极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O
B. b为阴离子交换膜
C. 阴极反应为2H20+2e-=H2↑+20H-,阴极区溶液pH升高
D. 铅蓄电池中消耗2molH2SO4时,理论上生成2molRH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料. 
(1)写出A在加热条件下与H2反应的化学方程式
(2)写出E与A的氢化物反应生成A的化学方程式
(3)写出一个由D生成B的化学方程式;
(4)将5mL0.10molL﹣1的E溶液与10mL0.10molL﹣1的NaOH溶液混合. ①写出反应的离子方程式;
②反应后溶液的pH7(填“大于”、“小于”或“等于”),理由是;
③加热反应后的溶液,其pH(填“增大”、“不变”或“减小”),理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com