
【题目】下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料. 
(1)写出A在加热条件下与H2反应的化学方程式
(2)写出E与A的氢化物反应生成A的化学方程式
(3)写出一个由D生成B的化学方程式;
(4)将5mL0.10molL﹣1的E溶液与10mL0.10molL﹣1的NaOH溶液混合. ①写出反应的离子方程式;
②反应后溶液的pH7(填“大于”、“小于”或“等于”),理由是;
③加热反应后的溶液,其pH(填“增大”、“不变”或“减小”),理由是 .
【答案】
(1)H2+S ![]() H2S
H2S
(2)H2SO3+2H2S═3S↓+3H2O
(3)C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)
CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O等
CuSO4+SO2↑+2H2O等
(4)H2SO3+2OH﹣═SO32﹣+2H2O;大于;Na2SO3溶液中SO32﹣发生水解使溶液显碱性;增大;升高温度促进Na2SO3溶液的水解
【解析】解:固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2 , C为SO3 , 它们的相对分子质量为64:80=4:5,恰好与题意相符(同时也证明A不是C),则D为H2SO4 , 它是一种重要的工业原料,与题意也相符,进一步证明A为S,E为H2SO3 , (1)A为S,可与氢气反应生成硫化氢,反应的方程式为H2+S ![]() H2S,所以答案是:H2+S
H2S,所以答案是:H2+S ![]() H2S;(2)H2SO3与H2S反应生成S,反应的方程式为H2SO3+2H2S═3S↓+3H2O,所以答案是:H2SO3+2H2S═3S↓+3H2O;(3)浓硫酸可与C、Cu等还原性物质在加热的条件下反应生成SO2 , 反应的方程式可为C+2H2SO4(浓)
H2S;(2)H2SO3与H2S反应生成S,反应的方程式为H2SO3+2H2S═3S↓+3H2O,所以答案是:H2SO3+2H2S═3S↓+3H2O;(3)浓硫酸可与C、Cu等还原性物质在加热的条件下反应生成SO2 , 反应的方程式可为C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)
CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O等,所以答案是:C+2H2SO4(浓)
CuSO4+SO2↑+2H2O等,所以答案是:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)
CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O等;(4)①将5mL 0.10molL﹣1的H2SO3溶液与10mL 0.10molL﹣1的NaOH溶液混合,二者恰好反应,反应的离子方程式为H2SO3+2OH﹣═SO32﹣+2H2O,所以答案是:H2SO3+2OH﹣═SO32﹣+2H2O;②反应生成Na2SO3 , 为强碱弱酸盐,水解呈碱性,溶液pH>7,所以答案是:大于;Na2SO3溶液中SO32﹣发生水解使溶液显碱性;③水解反应为吸热过程,升高温度促进水解,所以答案是:增大;升高温度促进Na2SO3溶液的水解.
CuSO4+SO2↑+2H2O等;(4)①将5mL 0.10molL﹣1的H2SO3溶液与10mL 0.10molL﹣1的NaOH溶液混合,二者恰好反应,反应的离子方程式为H2SO3+2OH﹣═SO32﹣+2H2O,所以答案是:H2SO3+2OH﹣═SO32﹣+2H2O;②反应生成Na2SO3 , 为强碱弱酸盐,水解呈碱性,溶液pH>7,所以答案是:大于;Na2SO3溶液中SO32﹣发生水解使溶液显碱性;③水解反应为吸热过程,升高温度促进水解,所以答案是:增大;升高温度促进Na2SO3溶液的水解.


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。E是同周期元素金属性最强的元素。甲、乙、丙、丁、戊是由上述部分元素中的两种或几种组成的化合物,它们的转化关系如图所示。其中甲是生活中的调味品,丁是淡黄色固体。下列说法不正确的是
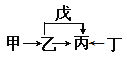
A. 原子半径由大到小的顺序为:r(E)>r(F)>r(C)>r(D)
B. 元素F的氧化物的水物化的酸性一定比硫酸酸性强
C. 元素B的氢化物可能具有正四面体结构
D. 化合物A4BC2D既可能是共价化合物,也可是离子化合物
【答案】B
【解析】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。E是同周期元素金属性最强的元素,则E为钠元素;根据流程图推导,且甲是生活中的调味品,丁是淡黄色固体,可知甲为氯化钠,丁为过氧化钠,则丙为碳酸钠,乙为氢氧化钠,戊是二氧化碳,则A、B、C、D、E、F分别为H、C、N、O、Na、Cl。A. 同周期性元素从左到右原子半径逐渐减小,同主族元素从上而下原子半径逐渐增大,故原子半径由大到小的顺序为:r(Na)>r(Cl)>r(N)>r(O),选项A正确;B. 元素Cl的最高价氧化物的水物化的酸性一定比硫酸酸性强,若不是最高价氧化物的水化物,则可能比较弱,如HClO是弱酸,选项B不正确;C. 元素B的氢化物CH4具有正四面体结构,选项C正确;D. 化合物A4BC2D既可能是共价化合物CO(NH2)2,也可是离子化合物NH4CNO,选项D正确。答案选B。
【题型】单选题
【结束】
6
【题目】下图所示装置可间接氧化工业废水中含氮离子(NH4+)。下列说法不正确的是

A. 乙是电能转变为化学能的装置
B. 含氮离子氧化时的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH减小
D. 电池工作时,甲池中的Na+移向Mg电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
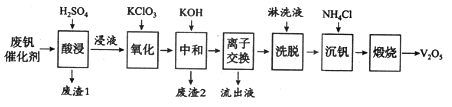
回答下列问题:
(1)五氧化二钒是一种催化剂,可将SO2转化为SO3,请写出该反应的化学方程式____________。
(2)“酸浸”时V2O5转化为VO2+,反应的离子方程式为_________________________,同时V2O4转成VO2+。“废渣1”的主要成分是_____________。
(3)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(4)“中和”作用之一是使钒以V4O124—形式存在于溶液中。“废渣2”中含有_______。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
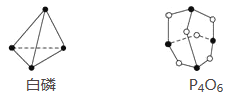
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产和生活中,人们广泛利用着化学反应释放的能量.下列说法正确的是( )
A.有能量变化的都是化学变化
B.物质发生化学变化并不一定都伴随着能量变化
C.用实验方法和理论方法研究反应热的化学称为热化学
D.任何反应中的能量变化都表现为热量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)为第VIA元素,其单质凭借优良的性能成为制作合金添加剂、半导体、光电元件的主体材料,并被广泛应用于冶金、航空航天、电子等领域。可从精炼铜的阳极泥(主要成分为Cu2Te)中回收碲,工艺流程如下 :
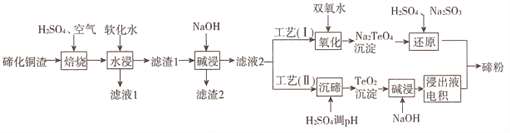
(1)“焙烧”后,碲主要以TeO2 形式存在,写出相应反应的化学方程式:_____________。
(2)为了选择最佳的焙烧工艺,进行了温度和硫酸加入量的条件试验,结果如下表所示:
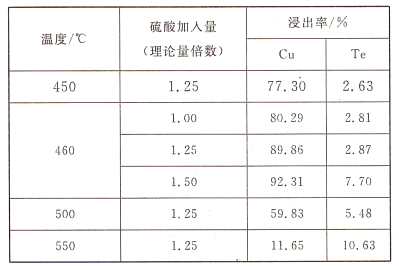
则实验中应选择的条件为_______________,原因为_______________。
(3)工艺( I)中,“还原”时发生的总的化学方程式为_______________。
(4)由于工艺(I)中“氧化”对溶液和物料条件要求高,有研究者采用工艺(II)获得碲。则“电积”过程中,阴极的电极反应式为_______________。
(5)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3 与滤液1合并,进入铜电积系统。该处理措施的优点为________________。
②滤渣3中若含Au和Ag,可用__________将二者分离。(填字母)
A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Mg(NO3)2和Al(NO3)3的混合溶液中,NO3﹣的物质的量为0.7mol.向该溶液中加入100mL 8molL﹣1的KOH溶液,使之充分反应,反应前,若Al3+的物质的量与混合溶液中离子总物质的量的比值为x. (不考虑Mg2+和Al3+的水解及水的电离所引起的离子总数的变化)
(1)x的取值范围是 .
(2)当KOH刚好完全消耗,且Al3+全部转化为AlO2﹣时,x的取值范围 .
(3)将(2)中的x值记为x1 , 则: 当0<x<x1时,反应生成的沉淀物的化学式为 .
当x>x1时反应生成的沉淀物的化学式为
(4)若反应前Al3+的物质的量为a mol,则a=(用含x的代数式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com