
����Ŀ����Mg��NO3��2��Al��NO3��3�Ļ����Һ�У�NO3�������ʵ���Ϊ0.7mol�������Һ�м���100mL 8molL��1��KOH��Һ��ʹ֮��ַ�Ӧ����Ӧǰ����Al3+�����ʵ���������Һ�����������ʵ����ı�ֵΪx�� ��������Mg2+��Al3+��ˮ�⼰ˮ�ĵ�������������������ı仯��
��1��x��ȡֵ��Χ�� ��
��2����KOH�պ���ȫ���ģ���Al3+ȫ��ת��ΪAlO2��ʱ��x��ȡֵ��Χ ��
��3������2���е�xֵ��Ϊx1 �� �� ��0��x��x1ʱ����Ӧ���ɵij�����Ļ�ѧʽΪ ��
��x��x1ʱ��Ӧ���ɵij�����Ļ�ѧʽΪ
��4������ӦǰAl3+�����ʵ���Ϊa mol����a=���ú�x�Ĵ���ʽ��ʾ����
���𰸡�
��1��0��x��0.25
��2��0.1
��3��Mg��OH��2��Al��OH��3��Mg��OH��2
��4��![]()
���������⣺��1������ȫΪAl��NO3��3ʱ��x�����ֵ����������ӵ����ʵ���Ϊ0.7mol���������ӵ����ʵ���Ϊ��0.7mol�� ![]() =
= ![]() mol����x=
mol����x= 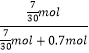 =0.25������������þ���������Ļ�����x��0.25������x�ķ�ΧΪ��0��x��0.25�����Դ��ǣ�0��x��0.25����2����KOH����ȫ������Al3+ȫ��ת����AlO2��ʱ����ʱ��Һ������ΪKNO3��KAlO2 �� �����غ��֪��n��K+��=n��NO3����+n��AlO2��������n��AlO2����=0.1L��8mol/L��0.7mol=0.1mol���ʣ�n��Al3+��=0.1mol�����ݵ���غ��֪��n��Mg2+��=
=0.25������������þ���������Ļ�����x��0.25������x�ķ�ΧΪ��0��x��0.25�����Դ��ǣ�0��x��0.25����2����KOH����ȫ������Al3+ȫ��ת����AlO2��ʱ����ʱ��Һ������ΪKNO3��KAlO2 �� �����غ��֪��n��K+��=n��NO3����+n��AlO2��������n��AlO2����=0.1L��8mol/L��0.7mol=0.1mol���ʣ�n��Al3+��=0.1mol�����ݵ���غ��֪��n��Mg2+��= ![]() =
= ![]() =0.2mol����x=
=0.2mol����x= ![]() =0.1�����Դ��ǣ�0.1����3����0��x��0.1ʱ���������ع�������������ȫת����AlO2�� �� ���ɵij���ΪMg��OH��2����0.1��x��0.25ʱ���������ز��㣬���ɵij���ΪAl��OH��3��Mg��OH��2�Ļ������Դ��ǣ�Mg��OH��2��Al��OH��3��Mg��OH��2����4������Һ��Al3+�����ʵ���Ϊa mol���ɵ���غ��֪Mg2+�����ʵ���Ϊ��
=0.1�����Դ��ǣ�0.1����3����0��x��0.1ʱ���������ع�������������ȫת����AlO2�� �� ���ɵij���ΪMg��OH��2����0.1��x��0.25ʱ���������ز��㣬���ɵij���ΪAl��OH��3��Mg��OH��2�Ļ������Դ��ǣ�Mg��OH��2��Al��OH��3��Mg��OH��2����4������Һ��Al3+�����ʵ���Ϊa mol���ɵ���غ��֪Mg2+�����ʵ���Ϊ�� ![]() ����Һ�������ܵ����ʵ���Ϊ��������֮�ͣ�Ҳ����
����Һ�������ܵ����ʵ���Ϊ��������֮�ͣ�Ҳ���� ![]() mol���ʣ�
mol���ʣ� ![]() +amol+0.7mol=
+amol+0.7mol= ![]() mol��
mol��
��ã�a= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾij��̬����A���仯����֮���ת����ϵ��ijЩ����ͷ�Ӧ��������ȥ����������B�ڳ��³�ѹ��Ϊ���壬B��C����Է�������֮��Ϊ4��5��������D����Ҫ�Ĺ�ҵԭ�ϣ� 
��1��д��A�ڼ�����������H2��Ӧ�Ļ�ѧ����ʽ
��2��д��E��A���⻯�ﷴӦ����A�Ļ�ѧ����ʽ
��3��д��һ����D����B�Ļ�ѧ����ʽ��
��4����5mL0.10molL��1��E��Һ��10mL0.10molL��1��NaOH��Һ��ϣ� ��д����Ӧ�����ӷ���ʽ��
�ڷ�Ӧ����Һ��pH7������ڡ�����С�ڡ����ڡ�������������
�ۼ��ȷ�Ӧ�����Һ����pH������������䡱��С������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H��C��N��C��Na��S��Fe����ѧ��ѧ�г�����Ԫ�أ����������ش�����ЩԪ���йص�����:
��1��FeԪ����Ԫ�����ڱ��е�λ��:___________________��
��2�� д��(CN)2�ĵ���ʽ: __________________��
��3���õ���ʽ��ʾNa3N ���γɹ���: __________________��
��4�����ֵ�������(NO��NO2)����Ҫ�Ĵ�����Ⱦ��֮һ��������������(NOx)�����ķ���֮һ����NaOH��Һ�������գ��䷴Ӧԭ���ɱ�ʾ����:
NO2 +NO+2NaOH=2NaNO2+H2O 2NO2 + 2NaOH =NaNO2+NaNO3+H2O
����NO ��NO2�Ļ�����壬����ͨ��50 mL 2 mol/L��NaOH ��Һ�У�ǡ����ȫ���գ������Һ�к���NO3-0.02 mol�����������v(NO): v(NO2)=_________��
��5�� ��FeI2��Һ�в���ͨ��Cl2����Һ��I-��I2��IO3-��Fe3+��Fe2+���������ʵ�����n(Cl2)/n(FeI2 )�ı仯������ͼ��ʾ
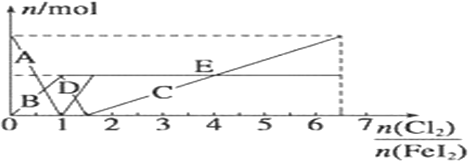
��n(Cl2)/n(FeI2 )=6.5 ʱ����Һ��n(Cl-)��n(IO3-)=_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ���ش��������⣺
��1��Ԫ�����ڱ�1��20��Ԫ���У���������ǿ��Ԫ����__________(��Ԫ�ط��ţ���ͬ)������ϡ���������________________���ǽ�������ǿ��Ԫ�������ڱ��е�λ����_______________________��
��2����֪NO2��N2O4֮�䷢�����淴Ӧ��2NO2 (g) (����ɫ) ![]() N2O4(g) (��ɫ)����װ��NO2 ��N2O4����������ƿ������ˮ�У��۲쵽��������____________________�������������ԭ����____________________________________��
N2O4(g) (��ɫ)����װ��NO2 ��N2O4����������ƿ������ˮ�У��۲쵽��������____________________�������������ԭ����____________________________________��
��3��һ�������£���2L�����ܱ������а������1:3����4.48L����״����N2��H2�Ļ�����壬������ӦN2��g��+3H2��g��![]() 2NH3��g��,3minʱ��Ӧ�ﵽƽ��״̬�����c(N2)=0.02mol��L��1��
2NH3��g��,3minʱ��Ӧ�ﵽƽ��״̬�����c(N2)=0.02mol��L��1��
�� 0��3min�ڣ�v (NH3)=___________________��
������������֤��������Ӧ�ﵽƽ��״̬����_________������ţ���
a. v(H2)= 3 v(N2) b.������ѹǿ���ֲ���
c.ÿ����1mol N2��ͬʱ����2mol NH3
d. N2��H2��NH3�����ʵ���Ũ�Ȳ��ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ÿ��Խ���������CO2ת��Ϊȼ������CO������˵���У�����ȷ����
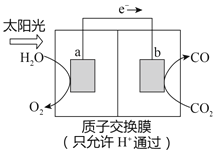
A. �缫b���淢����ԭ��Ӧ
B. ��װ�ù���ʱ��H+��a������b�����ƶ�
C. ��װ����ÿ����1molCO��ͬʱ����0.5molO2
D. �ù����ǽ���ѧ��ת��Ϊ���ܵĹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ�п��ܺ���SO42����CO32����Ϊ�����Ƿ���SO42����������BaCl2��Һ�⣬�����õ�����Һ��
A.ϡ����B.ϡ����C.NaOH��ҺD.NaNO3��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com