
����Ŀ���Թ�����Ϊ�����������������V2O5���ǽӴ�����������Ĵ������ӷϷ������л���V2O5�ȱ�����Ⱦ��������������Դ�ۺ����á��Ϸ���������Ҫ�ɷ�Ϊ��
���� | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
��������/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
������һ�ַϷ��������չ���·�ߣ�
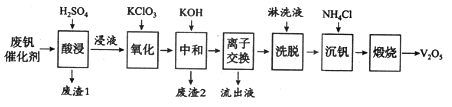
�ش��������⣺
��1��������������һ�ִ������ɽ�SO2ת��ΪSO3����д���÷�Ӧ�Ļ�ѧ����ʽ____________��
��2���������ʱV2O5ת��ΪVO2+����Ӧ�����ӷ���ʽΪ_________________________��ͬʱV2O4ת��VO2+��������1������Ҫ�ɷ���_____________��
��3��������������ʹ3 mol��VO2+��ΪVO2+������Ҫ������KClO3����Ϊ______mol��
��4�����к͡�����֮һ��ʹ����V4O124����ʽ��������Һ�С�������2���к���_______��
��5��������Һ����������������________��
��6�����������õ�ƫ����泥�NH4VO3��������д�������ա��з�����Ӧ�Ļ�ѧ����ʽ____________��
���𰸡� 2SO2+O2 ![]() 2SO3 V2O5��2H��=2VO2����H2O SiO2 0.5 Fe(OH)3��Al(OH)3 K�� 2NH4VO3
2SO3 V2O5��2H��=2VO2����H2O SiO2 0.5 Fe(OH)3��Al(OH)3 K�� 2NH4VO3![]() V2O5��H2O��2NH3��
V2O5��H2O��2NH3��
���������ӷϷ������л���V2O5�������̿�֪���������ʱV2O5ת��ΪVO2+��V2O4ת��VO2+������������������ת��Ϊ���������ӣ�ֻ��SiO2���ܣ�����˵õ�������1ΪSiO2��Ȼ���������KClO3����VO2+��ΪVO2+���ټ�KOHʱ�������ӡ�������ת��ΪFe(OH)3��Al(OH)3������ͬʱ�к����ᣬ���˵õ�������2ΪFe(OH)3��Al(OH)3��ͬʱʹ����V4O124����ʽ��������Һ�У������ӽ���������ϴ�����ɼ�ʾΪ��4ROH+V4O124-![]() R4V4O12+4OH-����ROHΪǿ���������ӽ�����֬��֪���������������÷�Ӧ�����ƶ�������Һ����ҪΪ����أ����������õ�ƫ�����(NH4VO3)��������������ʱ�ֽ�����V2O5��
R4V4O12+4OH-����ROHΪǿ���������ӽ�����֬��֪���������������÷�Ӧ�����ƶ�������Һ����ҪΪ����أ����������õ�ƫ�����(NH4VO3)��������������ʱ�ֽ�����V2O5��
(1)������������һ�ִ������ɽ�SO2ת��ΪSO3����Ӧ�Ļ�ѧ����ʽΪ2SO2+O2 ![]() 2SO3���ʴ�Ϊ��2SO2+O2
2SO3���ʴ�Ϊ��2SO2+O2 ![]() 2SO3��
2SO3��
(2)�������ʱV2O5ת��ΪVO2+����Ӧ�����ӷ���ʽΪV2O5+2H+=2VO2++H2O��������������֪����1ΪSiO2���ʴ�Ϊ��V2O5+2H+=2VO2++H2O��SiO2��
(3)������������ʹ3 mol��VO2+��ΪVO2+���ɵ����غ��֪������Ҫ������KClO3����Ϊ![]() =0.5mol���ʴ�Ϊ��0.5��
=0.5mol���ʴ�Ϊ��0.5��
(4)����������������֪����2ΪFe(OH)3��Al(OH)3���ʴ�Ϊ��Fe(OH)3��Al(OH)3��
(5)������������֪������Һ����ҪΪ����أ���������Һ����������������K+���ʴ�Ϊ��K+��
(6)���������з�����Ӧ�Ļ�ѧ����ʽΪ2NH4VO3![]() V2O5+H2O��+2NH3�����ʴ�Ϊ��2NH4VO3
V2O5+H2O��+2NH3�����ʴ�Ϊ��2NH4VO3![]() V2O5+H2O��+2NH3����
V2O5+H2O��+2NH3����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǹ�ˮ����[Cr(CH3COO)2]2��2H2O��һ���������ռ���Ϊ����ɫ���壬�ױ������������Ҵ���������ˮ������(�ӷ����л��ܼ�)�����Ʊ�װ�ü��������£�
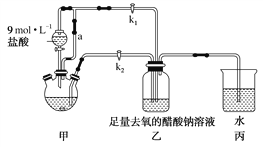
�ټ��װ�������ԣ���������ƿ�����μ������п�ۡ�����CrCl3��Һ��
�ڹر�k2��k1��������Һ©�������������ƺõ��١�
�۴�������ƿ�ڵ���Һ������ɫ(Cr3��)��Ϊ����ɫ(Cr2��)ʱ������Һת�Ƶ�װ�����У������ִ�������ɫ����ʱ���رշ�Һ©����������
�ܽ�װ�����л������ٹ��ˡ�ϴ�Ӻ�������õ�2.76 g[Cr(CH3COO)2]2��2H2O��
(1)װ�ü�����ͨ��a��������______________________��
(2)������ƿ�е�Zn��������������H2�⣬��������һ����Ӧ�����ӷ���ʽΪ______________________��
(3)ʵ�鲽�������Һ�Զ�ת����װ�����е�ʵ�����Ϊ______________________��
(4)װ�ñ��е��ܿ�ˮ���Ŀ����______________________��
(5)ϴ�Ӳ�Ʒʱ��Ϊ��ȥ�����������ʺ�ˮ�֣������Լ�����ȷʹ��˳����________(����ĸ)��
a�����ѡ�b��ȥ���������ˮ��c����ˮ�Ҵ�
(6)��ʵ����ȡ�õ�CrCl3��Һ�к�����3.17 g����[Cr(CH3COO)2]2��2H2O(��Է�������Ϊ376)�IJ�����______________________��
(7)һ�������£�[Cr(CH3COO)2]2��2H2O���ȵõ�CO��CO2�Ļ�����壬�����ʵ���������������Ĵ���________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��һ���������ȷ�Ӧ���ǣ�������
A.����Ȼ��ȼ���������ķ�Ӧ
B.������ԭ��Ӧ
C.��������������Ȼ�茶����Ͻ���
D.һ����̼��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʹ��֮ǰ��Ҫ����Ƿ�©Һ���ǣ�������
�ٷ�Һ©�� �ڳ���©�� ������ƿ ��������ƿ ��ϴ��ƿ��
A. �٢ڢ� B. �٢� C. �٢ۢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͻ�Na2CO3��Na2S�����Һ����ͨ��SO2����ȡNa2S2O3��ͬʱ�ų�CO2������˵������ȷ���ǣ� ��
A. ������Ӧ���������ͻ�ԭ�������ʵ�������2:l
B. ������Ӧ�е�Na2CO3��Na2S�����ʵ����������1:2
C. ÿ����lmol Na2S2O3ת��4mol����
D. Na2S2O3��������������ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ�����Ѿ��п�ȼ�ԣ���һ�ֳ��õ�ȼ�ϣ���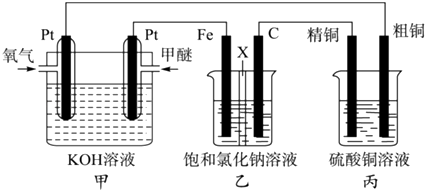
����Ҫ��ش��������
��1��װ�ü���ͨ��ȼ�ϼ��ѵ�һ�����������������������д�������ĵ缫��Ӧʽ��
��2��װ������FeΪ�����������������������ʯī�缫��C���ĵ缫��ӦʽΪ�� ��
��3�������ͭ�к���п���������ʣ���װ�õ��������к��� �� ��Ӧһ��ʱ�������ͭ��ҺŨ�Ƚ������������С�����䡱����
��4����װ�ü�������0.05molO2ʱ��װ��������Һ��pHΪ����Һ���Ϊ200mL���䣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƫ��������Һ����μ�������,�ܱ���pHֵ���ż�����������ı仯������ͼ��ʾ��������˵����ȷ����
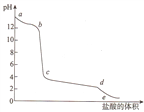
A. a��b�ε���Ҫ���ӷ���ʽΪA102-+4H+=Al3++2H2O
B. ��c����Һ�еμӰ�ˮ,���������ӷ���ʽΪA13++30H-=Al(OH)3��
C. c��d�ε���Ҫ���ӷ���ʽΪAl(OH)3+3H+= A13++3H2O
D. ��c����Һ�м���̼���ƣ����������ӷ���ʽΪ2 A13++CO32-+3H2O =2Al(OH)3��+CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾij��̬����A���仯����֮���ת����ϵ��ijЩ����ͷ�Ӧ��������ȥ����������B�ڳ��³�ѹ��Ϊ���壬B��C����Է�������֮��Ϊ4��5��������D����Ҫ�Ĺ�ҵԭ�ϣ� 
��1��д��A�ڼ�����������H2��Ӧ�Ļ�ѧ����ʽ
��2��д��E��A���⻯�ﷴӦ����A�Ļ�ѧ����ʽ
��3��д��һ����D����B�Ļ�ѧ����ʽ��
��4����5mL0.10molL��1��E��Һ��10mL0.10molL��1��NaOH��Һ��ϣ� ��д����Ӧ�����ӷ���ʽ��
�ڷ�Ӧ����Һ��pH7������ڡ�����С�ڡ����ڡ�������������
�ۼ��ȷ�Ӧ�����Һ����pH������������䡱��С������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H��C��N��C��Na��S��Fe����ѧ��ѧ�г�����Ԫ�أ����������ش�����ЩԪ���йص�����:
��1��FeԪ����Ԫ�����ڱ��е�λ��:___________________��
��2�� д��(CN)2�ĵ���ʽ: __________________��
��3���õ���ʽ��ʾNa3N ���γɹ���: __________________��
��4�����ֵ�������(NO��NO2)����Ҫ�Ĵ�����Ⱦ��֮һ��������������(NOx)�����ķ���֮һ����NaOH��Һ�������գ��䷴Ӧԭ���ɱ�ʾ����:
NO2 +NO+2NaOH=2NaNO2+H2O 2NO2 + 2NaOH =NaNO2+NaNO3+H2O
����NO ��NO2�Ļ�����壬����ͨ��50 mL 2 mol/L��NaOH ��Һ�У�ǡ����ȫ���գ������Һ�к���NO3-0.02 mol�����������v(NO): v(NO2)=_________��
��5�� ��FeI2��Һ�в���ͨ��Cl2����Һ��I-��I2��IO3-��Fe3+��Fe2+���������ʵ�����n(Cl2)/n(FeI2 )�ı仯������ͼ��ʾ
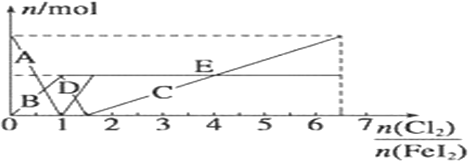
��n(Cl2)/n(FeI2 )=6.5 ʱ����Һ��n(Cl-)��n(IO3-)=_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com