
【题目】工业上将Na2CO3和Na2S配成溶液,再通入SO2可制取Na2S2O3,同时放出CO2。下列说法不正确的是( )
A. 上述反应中氧化剂和还原剂的物质的量比是2:l
B. 上述反应中的Na2CO3和Na2S的物质的量比最佳是1:2
C. 每生成lmol Na2S2O3转移4mol电子
D. Na2S2O3既是氧化产物,又是还原产物
科目:高中化学 来源: 题型:
【题目】J、L、M、R、T原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素
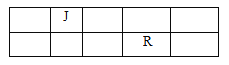
(1)写出R元素单质与26号元素单质化合的化学方程式______________________________。
(2)J和氢组成的化合物分子有6个原子,其结构简式为_______________________________________。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_________________。
(4)L的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)已知恒温、恒容条件下发生反应:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
①下列图像说明该反应进行到t1时刻未达平衡状态的是________(填选项字母)。
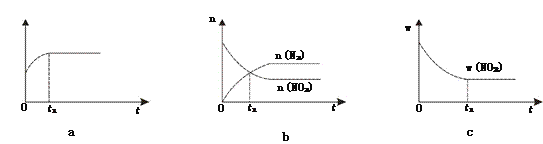
②1 molNO2和足量C发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示。

图中A、B、C三点NO2的转化率最高的是_____,该反应的平衡常数Kp=_______(Kp是用平衡分压代替平衡浓度的常数,分压=总压×物质的量分数)。
(2)已知:弱电解质的电离平衡常数为
物质 | H2CO | H2S | HNO2 |
电离平衡常数 (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸钠的溶液中加入1L 1mol·L-1的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
②25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=____mol·L-1;
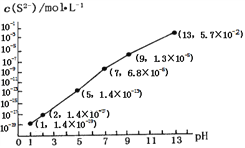
③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____性,其定量依据是______________________ .
(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H= -189.2kJmol-1
CaS(s)+4CO2(g) △H= -189.2kJmol-1
则:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=_______kJmol-1.
CaS(s)+3CO2(g) △H=_______kJmol-1.
【答案】 b A 2MPa c(HCO3- )>c(NO2- )>c(CO32-) 0.043或4.3×10-2 碱性 此时恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度远大于电离程度,所以呈碱性 -399.7
【解析】(1)①根据“变量不变达平衡”判断,a、反应中碳是固体,恒容条件下的混合物的密度是变量,t1时刻密度不变说明反应已达平衡状态;b、t1时刻是n(N2)=n(NO2),是反应物量的特殊比例,且后面量的变化可看到各反应物的量还没恒定,还没达到平衡状态;c、t1时刻二氧化氮的质量分数不变,则反应物各物质的质量分数也应不变,反应达到平衡状态;答案选b;②A、B、C三点中达到平衡状态后A点NO2浓度最小,所以NO2的转化率最高;③由焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生反应在C点时,NO2和CO2的物质的量浓度相等,可知此时反应体系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,则三种物质的分压分别为:P(NO2)= P(CO2)=10MPa×
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生反应在C点时,NO2和CO2的物质的量浓度相等,可知此时反应体系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,则三种物质的分压分别为:P(NO2)= P(CO2)=10MPa×![]() =4MPa,P(N2)=2MPa,C点时该反应的压强平衡常数Kp(C)=
=4MPa,P(N2)=2MPa,C点时该反应的压强平衡常数Kp(C)= 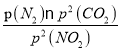 =
=![]() =2MPa;(2)①由亚硝酸的电离平衡常数Ka=5.1×10-4,H2CO的Ka1=4.2×10-7、Ka2=5.61×10-11可判断亚硝酸的酸性强于碳酸,因此向含有2mol碳酸钠的溶液中加入1mol的HNO2后生成1mol碳酸氢钠、1mol亚硝酸钠,另外还剩余1mol碳酸钠,水解程度大小顺序为CO32->NO2-,水解生成HCO3-,所以溶液中CO32-、HCO3-和NO2-离子的浓度大小关系为c(HCO3- )>c(NO2- )>c(CO32-);②根据物料守恒有c(H2S)+c(HS-)+c(S2-)=0.10 mol·L-1,而由图可知pH=13时,c(S2-)=5.7×10-2 mol·L-1,c(H2S)+c(HS-)=0.10 mol·L-1-c(S2-)=0.10 mol·L-1-5.7×10-2 mol·L-1= 4.3×10-2 mol·L-1;③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈碱性,其定量依据是此时恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度远大于电离程度,所以呈碱性;(3)已知:①CaSO4(s)+CO(g)
=2MPa;(2)①由亚硝酸的电离平衡常数Ka=5.1×10-4,H2CO的Ka1=4.2×10-7、Ka2=5.61×10-11可判断亚硝酸的酸性强于碳酸,因此向含有2mol碳酸钠的溶液中加入1mol的HNO2后生成1mol碳酸氢钠、1mol亚硝酸钠,另外还剩余1mol碳酸钠,水解程度大小顺序为CO32->NO2-,水解生成HCO3-,所以溶液中CO32-、HCO3-和NO2-离子的浓度大小关系为c(HCO3- )>c(NO2- )>c(CO32-);②根据物料守恒有c(H2S)+c(HS-)+c(S2-)=0.10 mol·L-1,而由图可知pH=13时,c(S2-)=5.7×10-2 mol·L-1,c(H2S)+c(HS-)=0.10 mol·L-1-c(S2-)=0.10 mol·L-1-5.7×10-2 mol·L-1= 4.3×10-2 mol·L-1;③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈碱性,其定量依据是此时恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度远大于电离程度,所以呈碱性;(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H1= +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H1= +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H2= -189.2kJmol-1
CaS(s)+4CO2(g) △H2= -189.2kJmol-1
根据盖斯定很,由②-①得反应:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=△H2-△H1= -189.2kJmol-1-210.5kJmol-1=-399.7kJmol-1。
CaS(s)+3CO2(g) △H=△H2-△H1= -189.2kJmol-1-210.5kJmol-1=-399.7kJmol-1。
点睛:本题主要是考查了弱电解质的电离、弱电解质的水解以及反应热计算等。该题考查的知识点较多,侧重考查学生对知识的迁移应用,注意信息的理解和综合应用。难点是电离平衡常数以及盐类水解的应用。解答时要明确电离平衡常数与化学平衡常数一样,平衡常数越大弱电解质的电离程度越大,从而可以判断相应酸碱的相对强弱,进而可以判断相应的盐的水解程度大小。(2)②中的计算要注意灵活应用物料守恒,同时要注意结合图像进行分析与计算。
【题型】综合题
【结束】
9
【题目】三氯化硼是重要的化工原料。可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5℃,熔点为-107.3℃;
②2B+6HCl![]() BCl3+3H2 ,硼也能与强碱反应。
BCl3+3H2 ,硼也能与强碱反应。
某研究性学习小组用如下所示装置制备三氯化硼。回答下列问题:
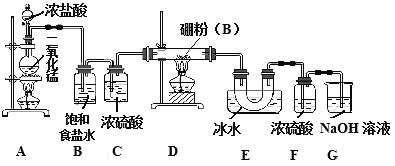
(1)A装置中反应的离子方程式_______________________。
(2)B装置的作用是____________;如果拆去B装置,可能的后果是__________________。
(3)D装置中发生反应的化学方程式_____________。
(4)G装置的作用是_____;为使实验装置简便,可用一个装置代替F和G装置。该装置所用仪器是___,所装试剂是____。
(5)A、D两处加热的先后顺序是_____________,其理由是_______________。
(6)检验制得的产品中是含有硼粉的实验操作是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+3Y(g)![]() 2Z(g) △H的能量变化如下图所示。下列说法正确的是
2Z(g) △H的能量变化如下图所示。下列说法正确的是

A. △H= E2- E1 B. 更换高效催化剂,E3不变
C. 恒压下充入一定量的氦气n(Z)减少 D. 压缩容器,c(X)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO ![]() )>c(CO
)>c(CO ![]() )>c(H2CO3)
)>c(H2CO3)
C.0.2mol?L﹣1 CH3COOH溶液与0.1mol?L﹣1 NaOH溶液等体积混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH)
D.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
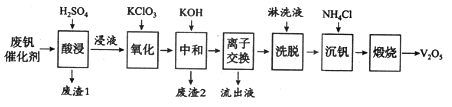
回答下列问题:
(1)五氧化二钒是一种催化剂,可将SO2转化为SO3,请写出该反应的化学方程式____________。
(2)“酸浸”时V2O5转化为VO2+,反应的离子方程式为_________________________,同时V2O4转成VO2+。“废渣1”的主要成分是_____________。
(3)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(4)“中和”作用之一是使钒以V4O124—形式存在于溶液中。“废渣2”中含有_______。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( ) 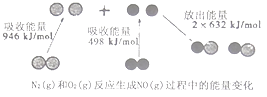
A.1molN2(g)和1molO2(g)反应放出的能量为180kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产和生活中,人们广泛利用着化学反应释放的能量.下列说法正确的是( )
A.有能量变化的都是化学变化
B.物质发生化学变化并不一定都伴随着能量变化
C.用实验方法和理论方法研究反应热的化学称为热化学
D.任何反应中的能量变化都表现为热量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 分散质微粒直径的大小关系:溶液>胶体>浊液
B. 利用丁达尔效应可以区别溶液与胶体
C. 胶体粒子比较小,可以通过半透膜
D. 电泳现象可证明胶体属于电解质溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com