
����Ŀ����ͼ��ʾ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ�����Ѿ��п�ȼ�ԣ���һ�ֳ��õ�ȼ�ϣ���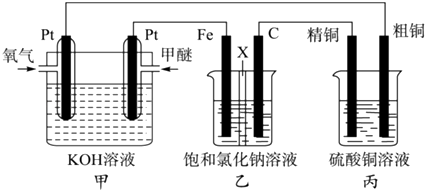
����Ҫ��ش��������
��1��װ�ü���ͨ��ȼ�ϼ��ѵ�һ�����������������������д�������ĵ缫��Ӧʽ��
��2��װ������FeΪ�����������������������ʯī�缫��C���ĵ缫��ӦʽΪ�� ��
��3�������ͭ�к���п���������ʣ���װ�õ��������к��� �� ��Ӧһ��ʱ�������ͭ��ҺŨ�Ƚ������������С�����䡱����
��4����װ�ü�������0.05molO2ʱ��װ��������Һ��pHΪ����Һ���Ϊ200mL���䣩
���𰸡�
��1��������O2+2H2O+4e���T4OH��
��2������2Cl����2e��=Cl2��
��3��Ag����С
��4��14
���������⣺��1��ȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�Ͷ��ȼ�ϵĵ缫�Ǹ�����Ͷ���������ĵ缫������������ͨ�������ĵ缫�������������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ������������ԭ��Ӧ���缫����ʽΪO2+2H2O+4e���T4OH�� �� ���Դ��ǣ�������O2+2H2O+4e���T4OH������2���ҳ�����ӵ�Դ���ڵ��أ����缫����ԭ��صĸ�������������������ʯī�缫�������������������ӷŵ������������缫��ӦʽΪ��2Cl����2e���TCl2�������Դ��ǣ����� 2Cl����2e��=Cl2������3�������ͭ�к���п���������ʣ������ϲ���ͭ����пʧ���ӽ�����Һ���������������������γɵ缫�࣬����������ͭ������ת�Ƶ��������֪���������ܽ��ͭС��������������ͭ�����Ա�װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ���С�� ���Դ��ǣ�Ag����С����4����װ�ü�������0.05molO2ʱ���ɵ缫����ʽO2+2H2O+4e���T4OH����֪ת��0.2mol���ӣ�װ��������������2H2O+2e��=H2+2OH�� �� ��֪����0.2molOH�� �� ��Һ���Ϊ200mL����c��OH����=1mol/L����pH=14�����Դ��ǣ�14��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����Ҫ�����������ᣨHN3����һ�����ᣬ��ͼΪ���ӽṹʾ��ͼ1���£�N2H4��������������ʱ�������������ᣨHN3����N2H4+HNO2�T2H2O+HN3 �� �������������ڴ��ᣬ���������H+��N3�� �� 
�Իش��������⣺
��1������˵����ȷ������ѡ����ţ���
A.���ԣ�HNO2��HNO3
B.N2H4��������ԭ�Ӳ��õĶ���sp2�ӻ�
C.HN3��H2O���Ǽ��Է���
D.N2H4�е�ߴ�113.5�棬˵���·��Ӽ���γ����
��2��������������Fe3+��Cu2+��Co3+���γ������磺[Co��N3����NH3��5]SO4 �� �ڸ�������������ۣ����ݼ۲���ӶԻ������ۿ�֪SO42�������幹��Ϊ �� д����ԭ���ڻ�̬ʱ�ĺ�������Ų�ʽ�� ��
��3���ɵ������ƣ�NaN3���ȷֽ�ɵô�N2��2NaN3��s���T2Na��l��+3N2��g��������˵����ȷ������ѡ����ţ���
A.NaN3��KN3�ṹ���ƣ�ǰ�߾����ܽ�С
B.�ƾ����ṹ��ͼ2�������з�̯2����ԭ��
C.���ĵ�һ�����ܴ�����
D.���������º��ȶ�������Ϊ��Ԫ�صĵ縺��С
��4����N3����Ϊ�ȵ�����ķ����У�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ȶ�����ѪҺ��PH������Ҫ���õ��ǣ�������
A.HCO3��
B.HSO3��
C.Na+
D.Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���������رգ���������һ�ֺ����������徭����ƿ��ͨ����ƿ����������ɫ�����ر���������������ͨ���������壬������ɫ����ƿ����ʢ���Լ�������
��Ũ���� �ڱ����Ȼ�����Һ ��NaOH��Һ �ܱ���̼������Һ ��ˮ

A. �٢� B. �ڢ� C. �ڢۢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
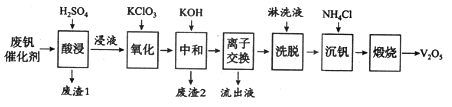
����Ŀ���Թ�����Ϊ�����������������V2O5���ǽӴ�����������Ĵ������ӷϷ������л���V2O5�ȱ�����Ⱦ��������������Դ�ۺ����á��Ϸ���������Ҫ�ɷ�Ϊ��
���� | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
��������/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
������һ�ַϷ��������չ���·�ߣ�
�ش��������⣺
��1��������������һ�ִ������ɽ�SO2ת��ΪSO3����д���÷�Ӧ�Ļ�ѧ����ʽ____________��
��2���������ʱV2O5ת��ΪVO2+����Ӧ�����ӷ���ʽΪ_________________________��ͬʱV2O4ת��VO2+��������1������Ҫ�ɷ���_____________��
��3��������������ʹ3 mol��VO2+��ΪVO2+������Ҫ������KClO3����Ϊ______mol��
��4�����к͡�����֮һ��ʹ����V4O124����ʽ��������Һ�С�������2���к���_______��
��5��������Һ����������������________��
��6�����������õ�ƫ����泥�NH4VO3��������д�������ա��з�����Ӧ�Ļ�ѧ����ʽ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ǽ������ϵ����ǡ����й��ڹ輰�仯�����������������
A.��������̫���ܵ�صij��ò���
B.����������������ά�Ļ���ԭ��
C.�轺����ʳƷ�������������������ֱ��ʳ��
D.������ܿ�ʴ���������Ƹ��־����IJ�����Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����P4O6�ķ��ӽṹ��ͼ��ʾ����֪��ѧ���ļ������γ�(��Ͽ�)1 mol��ѧ��ʱ�ͷ�(������)���������ֲ�֪P��P����Ϊ198 kJ��mol��1��P��O����Ϊ360 kJ��mol��1��O===O����Ϊ498 kJ��mol��1��������1 mol P4O6����ӦP4(����)��3O2=P4O6�е������仯Ϊ( )
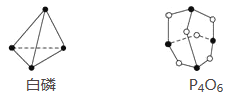
A. ����1 638 kJ���� B. �ų�1 638 kJ����
C. ����126 kJ���� D. �ų�126 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ���ڻ�ѧ��Ӧ���ɻ���̬��Ϊ����̬,���Ԫ��
A. һ�������� B. һ������ԭ
C. �ȿ��ܱ�����,Ҳ���ܱ���ԭ D. ���϶�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com