
【题目】质量比为16:7的两种气体 SO2、CO 分子个数之比为;氧原子个数之比为;同温同压下,等质量的SO2、CO体积比为 , 密度比为 .
科目:高中化学 来源: 题型:
【题目】下列仪器在使用之前需要检查是否漏液的是( )
①分液漏斗 ②长颈漏斗 ③容量瓶 ④蒸馏烧瓶 ⑤洗气瓶.
A. ①②③ B. ①③ C. ①③⑤ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料. 
(1)写出A在加热条件下与H2反应的化学方程式
(2)写出E与A的氢化物反应生成A的化学方程式
(3)写出一个由D生成B的化学方程式;
(4)将5mL0.10molL﹣1的E溶液与10mL0.10molL﹣1的NaOH溶液混合. ①写出反应的离子方程式;
②反应后溶液的pH7(填“大于”、“小于”或“等于”),理由是;
③加热反应后的溶液,其pH(填“增大”、“不变”或“减小”),理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】铜元素可形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的_____区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是__________。
②在[Cu(NH3)4]SO4中,Cu2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_________。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为________。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_________。但NF3不易与Cu2+形成化学键,其原因是_______________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为__________。
②已知该晶胞中两个Ba2+的间距为cpm.则距离Ba2+最近的Hg+数目为_____个,二者的最短距离为_______pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO3·3H2O2),有Na2CO3和H2O2的双重性质,用作漂白剂和氧化剂,可有效杀灭禽流感病毒。合理组合下列装置可用于测定过碳酸钠中碳酸钠的含量,下列说法不正确的是
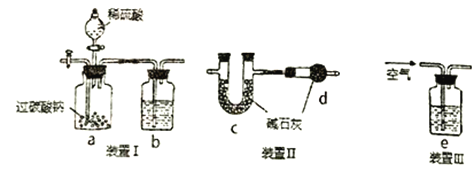
A. 装置皿→I→II的顺序连接装置
B. 装置b和e中盛放的试剂相同
C. d装置的作用是防止空气中的H2O和CO2进入到c中
D. 若b中盛放澄清的石灰水,只用装置I可验证过碳酸钠与硫酸反应是否生成CO2(不考虑空气CO2的影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、C、Na、S、Fe是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)Fe元素在元素周期表中的位置:___________________;
(2) 写出(CN)2的电子式: __________________;
(3)用电子式表示Na3N 的形成过程: __________________;
(4)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氨氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2 +NO+2NaOH=2NaNO2+H2O 2NO2 + 2NaOH =NaNO2+NaNO3+H2O
现有NO 与NO2的混合气体,将其通入50 mL 2 mol/L的NaOH 溶液中,恰好完全吸收,测得溶液中含有NO3-0.02 mol,混合气体中v(NO): v(NO2)=_________;
(5) 向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe3+、Fe2+等粒子物质的量随n(Cl2)/n(FeI2 )的变化可用下图简单表示
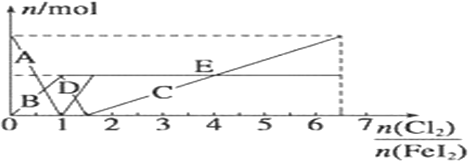
当n(Cl2)/n(FeI2 )=6.5 时,溶液中n(Cl-):n(IO3-)=_________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com