
【题目】下列变化中有化学键的断裂的是
A.HCl溶于水B.酒精的挥发C.干冰的升华D.裁剪布料
科目:高中化学 来源: 题型:
【题目】短周期元素 T、Q、R、W 在元素周期表中的位置如图所示,其中 T 所处的周期序数与主族 族序数相等.它们的最高价氧化物水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
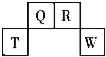
A. 甲、乙、丙、丁受热均易分解
B. 常温下丁的浓溶液可用 T 单质所制的容器来盛装
C. 丁的浓溶液与 Q 的单质加热发生反应,可生成体积比为 1:2 的两种气体
D. R 的氧化物在空气中与其它物质作用可形成光化学烟雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,下列五种溶液:①0.1mol/LNH4Cl②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4 ④0.1mol/L NH3H2O和0.1mol/LNH4Cl混合液⑤0.1mol/LNH3H2O,请根据要求填写下列空白:
(1)溶液①呈性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是;c(NH4+)最小的是(填序号)
(3)比较溶液②、③中c(NH4+)的大小关系是②③(填“>”、“<”或“=”)
(4)在溶液④中,离子的浓度为0.1mol/L;NH3H2O和离子的物质的量浓度之和为0.2mol/L
(5)常温下,测得溶液②的pH=7,则说明CH3COO﹣的水解程度(填“>”、“<”或“=”)NH4+ 的水解程度,CH3COO﹣与NH4+浓度的大小关系是:c(CH3COO﹣)c(NH ![]() )(填“>”、“<”或“=”)
)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3 . 它的酸性类似于醋酸,可微弱电离出H+和N3﹣ . 
试回答下列问题:
(1)下列说法正确的是(选填序号).
A.酸性:HNO2>HNO3
B.N2H4中两个氮原子采用的都是sp2杂化
C.HN3、H2O都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4 , 在该配合物中钴显价,根据价层电子对互斥理论可知SO42﹣的立体构型为 , 写出钴原子在基态时的核外电子排布式: .
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)═2Na(l)+3N2(g),下列说法正确的是(选填序号).
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图2,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮元素的电负性小
(4)与N3﹣互为等电子体的分子有:(举两例).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,有两瓶体积相等的CO和CO2,这两种气体中所含的分子数目之比为___,质量比为________。
(2)在Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O反应中,
CuSO4+ SO2↑+ 2H2O反应中,
①________是氧化剂。
②用双线桥标出该反应电子转移的方向和数目。_________________
Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O
CuSO4+ SO2↑+ 2H2O
③若有2.4mol的H2SO4参与反应,生成标况下的二氧化硫气体_______ L,转移电子的数目为_______________。(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上合成有机玻璃流程为:

下列说法不正确的是
A. 反应①的原子利用率达100%
B. 反应②是加聚反应
C. 相对分子质量为86,且与甲基丙烯酸甲酯具有相同官能团的有机物有5种
D. 甲基丙烯酸甲酯能使酸性高锰酸钾褪色,也能使Br2/CCl4褪色,二者原理相同
【答案】D
【解析】A、反应①为加成反应,没有副产物,则原子利用率为100%,选项A正确;B、反应②为碳碳双键发生的加聚反应,该反应为: ,选项B正确;C、相对分子质量为86,且与甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]具有相同官能团的有机物应该含有一个酯基和一个碳碳双键且碳原子数为4,有HCOOCH=CHCH3、HCOOCH2CH=CH2、CH3COOCH=CH2、CH2=CHCOOCH3、HCOOC(CH3)=CH2共5种,选项C正确;D、甲基丙烯酸甲酯能被酸性高锰酸钾氧化而使其褪色,也能与溴发生加成反应而使Br2的CCl4溶液褪色,二者原理不相同,选项D不正确。答案选D。
,选项B正确;C、相对分子质量为86,且与甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]具有相同官能团的有机物应该含有一个酯基和一个碳碳双键且碳原子数为4,有HCOOCH=CHCH3、HCOOCH2CH=CH2、CH3COOCH=CH2、CH2=CHCOOCH3、HCOOC(CH3)=CH2共5种,选项C正确;D、甲基丙烯酸甲酯能被酸性高锰酸钾氧化而使其褪色,也能与溴发生加成反应而使Br2的CCl4溶液褪色,二者原理不相同,选项D不正确。答案选D。
【题型】单选题
【结束】
4
【题目】按如图各装置进行实验能成功完成相应实验的是

A. 图1:证明非金属性强弱:C>Si B. 图2:制备氢氧化亚铁
C. 图3:分离碘并回收苯 D. 图4:制取和收集乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。E是同周期元素金属性最强的元素。甲、乙、丙、丁、戊是由上述部分元素中的两种或几种组成的化合物,它们的转化关系如图所示。其中甲是生活中的调味品,丁是淡黄色固体。下列说法不正确的是
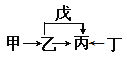
A. 原子半径由大到小的顺序为:r(E)>r(F)>r(C)>r(D)
B. 元素F的氧化物的水物化的酸性一定比硫酸酸性强
C. 元素B的氢化物可能具有正四面体结构
D. 化合物A4BC2D既可能是共价化合物,也可是离子化合物
【答案】B
【解析】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。E是同周期元素金属性最强的元素,则E为钠元素;根据流程图推导,且甲是生活中的调味品,丁是淡黄色固体,可知甲为氯化钠,丁为过氧化钠,则丙为碳酸钠,乙为氢氧化钠,戊是二氧化碳,则A、B、C、D、E、F分别为H、C、N、O、Na、Cl。A. 同周期性元素从左到右原子半径逐渐减小,同主族元素从上而下原子半径逐渐增大,故原子半径由大到小的顺序为:r(Na)>r(Cl)>r(N)>r(O),选项A正确;B. 元素Cl的最高价氧化物的水物化的酸性一定比硫酸酸性强,若不是最高价氧化物的水化物,则可能比较弱,如HClO是弱酸,选项B不正确;C. 元素B的氢化物CH4具有正四面体结构,选项C正确;D. 化合物A4BC2D既可能是共价化合物CO(NH2)2,也可是离子化合物NH4CNO,选项D正确。答案选B。
【题型】单选题
【结束】
6
【题目】下图所示装置可间接氧化工业废水中含氮离子(NH4+)。下列说法不正确的是

A. 乙是电能转变为化学能的装置
B. 含氮离子氧化时的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH减小
D. 电池工作时,甲池中的Na+移向Mg电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
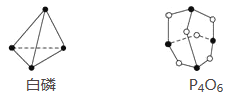
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com