
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_______________________________________。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为_____________________。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______________mol·L-1(填精确计算结果)。
(5) 将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为__________________________。
【答案】 c(K+)> c(HC2O4-) >c(H+)>c(C2O42-) >c(OH-) 5 2CO32-+Cl2+H2O = Cl-+ClO-+2HCO3- 9.9*10-7(合理答案给分) c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】试题分析:(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液中溶质是KHC2O4,溶液呈酸性说明HC2O4-电离程度大于水解程度;(2)根据CH3COOH的电离平衡常数,计算当c(CH3COOH)∶c(CH3COO-)=5∶9时H+的浓度;(3)盐酸、次氯酸的酸性都大于HCO3-,根据强制弱的规律判断碳酸钠溶液中滴加少量氯水的产物;(4)根据电荷守恒计算c(Na+)-c(CH3COO-)的值;(5)标况下44.8L二氧化碳气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,得到等物质的量浓度的碳酸钠、碳酸氢钠溶液。
解析:(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液中溶质是KHC2O4,溶液呈酸性说明HC2O4-电离程度大于水解程度,再结合氢离子来自HC2O4-的电离和水的电离,所以c(H+)>c(C2O42-) >c(OH-),各离子浓度由大到小的顺序为c(K+)> c(HC2O4-) >c(H+)>c(C2O42-) >c(OH-);
(2)根据CH3COOH的电离平衡常数 ,把c(CH3COOH)∶c(CH3COO-)=5∶9带入,得c(H+)=1×10-5,所以PH=5;
,把c(CH3COOH)∶c(CH3COO-)=5∶9带入,得c(H+)=1×10-5,所以PH=5;
(3)盐酸、次氯酸的酸性都大于HCO3-,根据强制弱的规律,碳酸钠溶液中滴加少量氯水生成氯化钠、次氯酸钠、碳酸氢钠,反应的离子方程式是2CO32-+Cl2+H2O = Cl-+ClO-+2HCO3-;
(4)pH=8,c(H+)=1×10-8,c(OH-)=![]() ,根据电荷守恒,c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),c(Na+)-c(CH3COO-)= c(OH-)-c(H+)=9.9×10-7;
,根据电荷守恒,c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),c(Na+)-c(CH3COO-)= c(OH-)-c(H+)=9.9×10-7;
(5)标况下44.8L二氧化碳气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,生成等物质的量浓度的碳酸钠、碳酸氢钠溶液, c(CO32-)水解程度大于c(HCO3-),所以c(HCO3-)>c(CO32-),溶液呈碱性,所以c(OH-)>c(H+),故离子大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】如图1是某同学在实验室中进行铝热反应(铝过量)的实验装置,实验中他观察到的现象之一为“纸漏斗的下部被烧穿,有熔融物落入沙中”。

(1)写出该反应的化学方程式:________________________________________________。
(2)为检验铝热反应后的固体成分,请填写下表:
检验成分 | 操作步骤 | 实验现象与结论 |
铝 | ____________ | ___________ |
氧化铁 | _____________ | ____________ |
(3)探究铝热反应后固体的性质:将反应后容器中的固体残余置于烧杯中,加入一定量稀硝酸,固体完全溶解,反应过程中无气体放出(活泼金属可把稀HNO3)还原为NH4NO3)。在反应后的溶液中缓慢滴加4 mol·L-1的NaOH溶液,产生沉淀的物质的量(mol)与加入NaOH溶液的体积(ml)的关系如图2所示:
①1写出DE段发生反应的离子方程式:_____________________________________________。
②B与A的差值为_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式的反应热表示可燃物的燃烧热的是
A. H2(g)+I2(g)![]() 2HI(g) △H=-9.48 kJ mol-1
2HI(g) △H=-9.48 kJ mol-1
B. CH4(g)+2O2(g)=2H2O(g)+CO2(g) △H =-802.3 kJ mol-1
C. 2CO(g)+O2(g)= 2CO2(g) △H=-566 kJ mol-1
D. H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8 kJ mol-1
O2(g)=H2O(l) △H=-285.8 kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取O2。下列有关说法不正确的是
①光催化分解水制氧气:2H2O(l)=2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l) + O2(g) ΔH2=-196.4 kJ·mol-1
③一氧化氮分解制氧气:2NO(g)=N2(g) + O2(g) ΔH3=-180.5 kJ·mol-1
A. 反应①是人们获取H2的途径之一
B. 反应②、③都是化学能转化为热能
C. 反应H2O2(l)=H2O(g)+ ![]() O2(g)的ΔH=-98.2 kJ·mol-1
O2(g)的ΔH=-98.2 kJ·mol-1
D. 反应2H2(g)+2NO(g)=N2(g)+2H2O(l)的ΔH=-752.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Yohiaki Nakao报道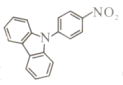 (b)在Pd催化下可发生Buchwald-Hartwig偶联反应。下列说法不正确的是
(b)在Pd催化下可发生Buchwald-Hartwig偶联反应。下列说法不正确的是
A. b的分子式为C18H12N2O2
B. b的一氯代物有4种
C. b可发生取代反应
D. b的所有原子不一定共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中,不能说明反应:C(s) +CO2(g)![]() 2CO(g)已达到平衡状态的是
2CO(g)已达到平衡状态的是
A. 每消耗1 mol CO2的同时生成2 mol CO
B. 混合气体的平均相对分子质量不再改变
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是 ( )

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型不同
C. 1mol分枝酸与足量的Na反应可产生1.5mol H2
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com