
【题目】Yohiaki Nakao报道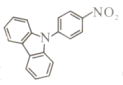 (b)在Pd催化下可发生Buchwald-Hartwig偶联反应。下列说法不正确的是
(b)在Pd催化下可发生Buchwald-Hartwig偶联反应。下列说法不正确的是
A. b的分子式为C18H12N2O2
B. b的一氯代物有4种
C. b可发生取代反应
D. b的所有原子不一定共平面
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I、乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图的装置制备乙酸乙酯。
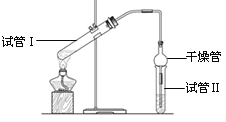
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:_____________。
(2)请写出用CH3CH218OH制备乙酸乙酯的化学方程式:_____________,反应类型为_______。
(3)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验 编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中的试剂 | 有机层的厚度/cm |
A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
②分析实验_________________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(4)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________(用百分数表示,保留一位小数)。
II、已知乳酸的结构简式为![]() 。试回答:
。试回答:
①乳酸分子中的官能团有:_____________________________________(写名称);
②乳酸与足量金属钠反应的化学方程式为________________________________;
③已知—COOH不会发生催化氧化,写出加热时,乳酸在Cu作用下与O2反应的化学方程式:________________________________________________;
④腈纶织物产泛地用作衣物、床上用品等。腈纶是由CH2=CH-CN聚合而成的。 写出在催化剂、加热条件下制备腈纶的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A. v正(X)=v逆(Z)
B. 容器内压强不随时间变化
C. 容器内X、Y、Z的浓度之比为l:2:2
D. 单位时间内消耗0.1 mol X的同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_______________________________________。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为_____________________。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______________mol·L-1(填精确计算结果)。
(5) 将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀碳酸钙主要用于食品、医药等行业。以精选石灰石(含有少量MgCO3、FeCO3杂质)为原料制备沉淀碳酸钙的工艺流程如下:

(1)流程中可以循环利用的物质有气体Ⅰ、气体Ⅱ和__________(填化学式)。
(2)“碳化”时发生反应的离子方程式为________________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________________。
(3)工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:

①电解过程中,加入氯化钙的目的是________________。
②石墨电极发生的电极反应方程式为________________。
③电解得到的Na中约含1%的Ca,除去其中少量Ca的方法为________________。
已知部分物质的熔沸点如下表:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个隔热恒容的密闭容器中进行下列两个可逆反应:甲中:C(s)+H2O(g) ![]() CO(g)+H2(g);乙中:CO(g)+H2O(g)
CO(g)+H2(g);乙中:CO(g)+H2O(g) ![]() CO2(g)+H2(g)。现有下列状态:①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变 ③各气体组分浓度相等 ④反应体系中温度保持不变 ⑤断裂氢氧键反应速率等于断裂氢氢键反应速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水的质量与生成氢气的质量之比为9∶1 ⑧同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明甲、乙容器中反应都达到平衡状态的是
CO2(g)+H2(g)。现有下列状态:①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变 ③各气体组分浓度相等 ④反应体系中温度保持不变 ⑤断裂氢氧键反应速率等于断裂氢氢键反应速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水的质量与生成氢气的质量之比为9∶1 ⑧同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明甲、乙容器中反应都达到平衡状态的是
A. ④⑤⑧ B. ③④⑥ C. ⑥⑦⑧ D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ/mol,在V2O5存在时,该反应的机理为:V2O5+SO2![]() 2VO2+SO3(快) 4VO2+O2
2VO2+SO3(快) 4VO2+O2![]() 2V2O5(慢)
2V2O5(慢)
下列说法正确的是
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 逆反应的活化能大于198kJ/mol D. 增大SO2的浓度可显著提高反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com