
【题目】钠与水反应的现象之一:熔化成光亮小球其原因为:__________,该反应方程式为:_______。
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】Yohiaki Nakao报道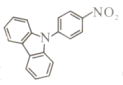 (b)在Pd催化下可发生Buchwald-Hartwig偶联反应。下列说法不正确的是
(b)在Pd催化下可发生Buchwald-Hartwig偶联反应。下列说法不正确的是
A. b的分子式为C18H12N2O2
B. b的一氯代物有4种
C. b可发生取代反应
D. b的所有原子不一定共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H="a" kJ mol-1。
O2(g) △H="a" kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。

① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是 ( )

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型不同
C. 1mol分枝酸与足量的Na反应可产生1.5mol H2
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是______________。
(2)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水。已知E的分子式为C3H6O3,则:
①实验证实其中含有羟基,羧基,甲基,则E的结构简式为______________。
②写出E与足量Na反应的化学方程式_____________________________________。
③写出E与足量NaHCO3反应的化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)。
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入Cl2,将Br-氧化,该反应的离子方程式是____。
(3)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是________,转Mg(OH)2化为MgCl2的离子方程式是____________。
②由无水MgCl2制取Mg的化学方程式是________________________。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
![]()
①灼烧海带时所用的主要仪器名称是________________。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式_______________________。
反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的HA和HB分别与0.10 mol·L-1的NaOH溶液等体积混合,记录数据如下表,下列说法中正确的是
混合后的溶液 | 加入的酸 | 酸的浓度/(mol·L-1) | 混合后溶液的pH |
① | HA | 0.10 | 8.7 |
② | HB | 0.12 | 2 |
A. HA是强酸,HB是弱酸
B. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+)
C. 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1
D. 升高温度,溶液②中![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com