
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H="a" kJ mol-1。
O2(g) △H="a" kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。

① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)
【答案】(1)> ;>
(2)①0.005 mol L-1 min-1
②BC
③移走 0.1 molNH3; =
【解析】试题分析:(1)升高温度NH3的物质的量最多,所以N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2反应吸热,a>0;反应后气体物质的量增多,△S>0;(2)① 0~10 min内,以NH3表示的平均反应速率为
O2反应吸热,a>0;反应后气体物质的量增多,△S>0;(2)① 0~10 min内,以NH3表示的平均反应速率为![]()
![]() 0.005 mol L-1 min-1;② 在10~20 min内,NH3浓度逐渐增大,变化的原因可能是A.加入催化剂,平衡不移动,NH3物质的量不变,A错误; B.缩小容器体积,平衡正向移动,氨气的物质的量增大,B正确 ; C.降低温度,平衡正向移动,NH3物质的量增大,C正确; D.增加NH3的物质的量,平衡逆向移动,氮气、氢气增多,D错误;③ 在反应进行至25 min时,氨气的物质的量突然由0.3mol变为0.2mol,曲线发生变化的原因是移走 0.1 molNH3,平衡常数只与温度有关,温度不变平衡常数不变,达到第二次平衡时,新平衡的平衡常数K2=K1。
0.005 mol L-1 min-1;② 在10~20 min内,NH3浓度逐渐增大,变化的原因可能是A.加入催化剂,平衡不移动,NH3物质的量不变,A错误; B.缩小容器体积,平衡正向移动,氨气的物质的量增大,B正确 ; C.降低温度,平衡正向移动,NH3物质的量增大,C正确; D.增加NH3的物质的量,平衡逆向移动,氮气、氢气增多,D错误;③ 在反应进行至25 min时,氨气的物质的量突然由0.3mol变为0.2mol,曲线发生变化的原因是移走 0.1 molNH3,平衡常数只与温度有关,温度不变平衡常数不变,达到第二次平衡时,新平衡的平衡常数K2=K1。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ/mol,在V2O5存在时,该反应的机理为:V2O5+SO2![]() 2VO2+SO3(快) 4VO2+O2
2VO2+SO3(快) 4VO2+O2![]() 2V2O5(慢)
2V2O5(慢)
下列说法正确的是
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 逆反应的活化能大于198kJ/mol D. 增大SO2的浓度可显著提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL0.1mol·L-1醋酸溶液中不断滴入0.1mol·L-1的NaOH溶液,溶液pH变化如图所示。下列叙述错误的是

A. a点:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B. b点:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. c点:c(OH-)=c(CH3COOH)+c(H+)
D. d点:2c (Na+)=3[c(CH3COOH)+c(CH3COO-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用HCl气体“置换”除水,升华相结合的方法从市售的氯化锌制备高纯度无水氯化锌,装置如图所示[市售氯化锌含Zn(OH)Cl]。下列说法不正确的是

A. 恒压漏斗的作用是平衡气体压强
B. 管式炉Ⅰ采取的升温方式是阶段式升温
C. 实验时,应先撒去管式炉Ⅰ,再撤去管式炉Ⅱ
D. 在尾气吸收装置前应增加一个干燥装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用浓度为0.20mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。

(1)准确量取一定体积的待测液需要使用的仪器是______________。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。
(4)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数 | 待测液体积(mL) | 0.20mol·L-1的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20. 60 |
第一次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为__________。
(5)下列操作会导致测得的待测液的浓度偏大的是________(填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应COCl2(g)![]() CO(g)+Cl2(g) △H>0。改变下列条件,能加快反应速率,且CO物质的量分数增大的是
CO(g)+Cl2(g) △H>0。改变下列条件,能加快反应速率,且CO物质的量分数增大的是
A. 恒容下通入He B. 恒容下增大COCl2浓度 C. 升温 D. 加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛被认为是现今世界上性能最好的一种白色颜料。同时它有较好的紫外线掩蔽作用,超细的二氧化钛粉末也被加入到防晒膏中制成防晒化妆品。现在某实验小组按照下面的流程来合成纳米二氧化钛。
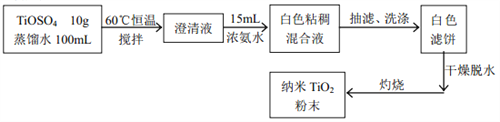
实验机理: TiOSO4+2NH3H2O = TiO(OH)2↓+(NH4)2SO4
信息提示:①钛元素化合物的性质和铝有一定的相似性。TiO2具有两性,Ti(OH)4不稳定,容易失去一分子水形成TiO(OH)2。
②钛的原子量: 48
③浓氨水的密度:0.91g cm-3
(1)灼烧时用到的硅酸盐容器是_______。
(2)下列说法正确的是_______。
A. 为了加快反应速率,可以用氢氧化钠溶液代替浓氨水
B. 为了提高产率,反应容器需要用滤液洗
C. 为了防止抽滤时滤纸破裂,抽滤时可以使用两层滤纸
D. 为了加快干燥的速率,干燥时可以用小火加热
E. 灼烧后需要冷却到室温,称量一次所得数值即为 TiO2的质量
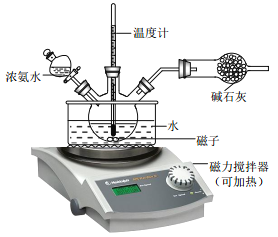
(3)为了使实验过程中尽可能的减少环境污染,同时要注意操作的安全性, 请你指出该反应装置图中的需要改进之处(指出两处即可)_____________。
(4)反应后的白色粘稠混合液经过抽滤、洗涤可以得到白色滤饼。如何证明白色滤饼已经洗干净了呢?_____。
(5)焙烧后有时会有少量的TiO2残留在容器中无法去除,我们可以用NaOH溶液将残留的TiO2洗干净。请你用化学方程式表示该洗涤原理___________。
(6)最后称得纳米 TiO2 的质量是a 克,请你计算用该方法制备 TiO2的产率________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com