
【题目】二氧化钛被认为是现今世界上性能最好的一种白色颜料。同时它有较好的紫外线掩蔽作用,超细的二氧化钛粉末也被加入到防晒膏中制成防晒化妆品。现在某实验小组按照下面的流程来合成纳米二氧化钛。
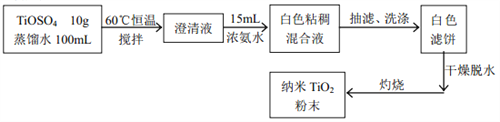
实验机理: TiOSO4+2NH3H2O = TiO(OH)2↓+(NH4)2SO4
信息提示:①钛元素化合物的性质和铝有一定的相似性。TiO2具有两性,Ti(OH)4不稳定,容易失去一分子水形成TiO(OH)2。
②钛的原子量: 48
③浓氨水的密度:0.91g cm-3
(1)灼烧时用到的硅酸盐容器是_______。
(2)下列说法正确的是_______。
A. 为了加快反应速率,可以用氢氧化钠溶液代替浓氨水
B. 为了提高产率,反应容器需要用滤液洗
C. 为了防止抽滤时滤纸破裂,抽滤时可以使用两层滤纸
D. 为了加快干燥的速率,干燥时可以用小火加热
E. 灼烧后需要冷却到室温,称量一次所得数值即为 TiO2的质量
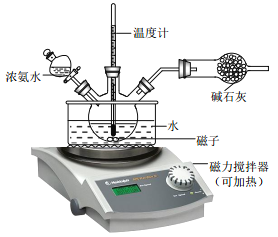
(3)为了使实验过程中尽可能的减少环境污染,同时要注意操作的安全性, 请你指出该反应装置图中的需要改进之处(指出两处即可)_____________。
(4)反应后的白色粘稠混合液经过抽滤、洗涤可以得到白色滤饼。如何证明白色滤饼已经洗干净了呢?_____。
(5)焙烧后有时会有少量的TiO2残留在容器中无法去除,我们可以用NaOH溶液将残留的TiO2洗干净。请你用化学方程式表示该洗涤原理___________。
(6)最后称得纳米 TiO2 的质量是a 克,请你计算用该方法制备 TiO2的产率________。
【答案】 坩埚 BCD ①将分液漏斗改成恒压漏斗,避免玻璃塞打开时浓氨水挥发污染环境;②因为三颈烧瓶里面有磁子,所以温度计放在外面可以避免被打碎。(温度计测水浴的温度,所以应该放在外面。)所以干燥管里放 P2O5 或无水氯化钙用于吸收氨气 取最后一次洗涤液,滴加 BaCl2 溶液,若出现白色浑浊,说明沉淀还没有洗干净;若没有白色浑浊,说明沉淀已经洗干净了 TiO2+2NaOH=Na2TiO3+H2O a/5
【解析】(1)黏土主要成分是硅酸盐,坩埚是由黏土烧制而成;正确答案:坩埚。
(2)根据题给信息钛元素化合物的性质和铝有一定的相似性,可知氢氧化钛能够溶于强碱,不溶于弱碱,所以不能用氢氧化钠溶液代替浓氨水,A错误;反应容器需要用滤液洗,减少生成的损失,提高了产率,B正确;为了防止抽滤时滤纸破裂,抽滤时可以使用两层滤纸,防止滤纸被弄破,C正确;干燥时可以用小火加热,可以使水分挥发完全,防止氢氧化钛的分解,加快干燥的速率,D正确; 灼烧后需要冷却到室温,至少称量2次,所得数值误差相差不到0.1克,即为 TiO2的质量,E错误;正确选项BCD。
(3)从减少环境污染角度分析,将分液漏斗改成恒压漏斗,避免玻璃塞打开时浓氨水挥发污染环境,同时干燥管里放 P2O5 或无水氯化钙用于吸收氨气;从操作的安全性角度分析,因为三颈烧瓶里面有磁子,所以温度计放在外面可以避免被打碎;正确答案:①将分液漏斗改成恒压漏斗,避免玻璃塞打开时浓氨水挥发污染环境;②因为三颈烧瓶里面有磁子,所以温度计放在外面可以避免被打碎。(温度计测水浴的温度,所以应该放在外面。)所以干燥管里放 P2O5 或无水氯化钙用于吸收氨气。
(4)检验白色滤饼固体中是否附着有硫酸根离子(用稀盐酸和氯化钡溶液),如果检验不出硫酸根离子,证明白色滤饼已经洗干净;正确答案:取最后一次洗涤液,滴加 BaCl2 溶液,若出现白色浑浊,说明沉淀还没有洗干净;若没有白色浑浊,说明沉淀已经洗干净了。
(5)TiO2具有两性,能够与强碱溶液反应生成可溶性的钛酸钠,化学方程式为:TiO2+2NaOH=Na2TiO3+H2O;正确答案:TiO2+2NaOH=Na2TiO3+H2O 。
(6)根据钛元素守恒规律:理论上TiOSO4→TiO2,钛元素没有损失,根据题意可知n(TiOSO4)=10/160mol, n(TiO2)= 10/160mol,m(TiO2)=(10÷160)×80=5g,据题意最后称得纳米 TiO2 的质量是a 克,TiO2的产率为a/5×100%=20a%;正确答案:20a%或a/5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H="a" kJ mol-1。
O2(g) △H="a" kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。

① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
Ⅰ C10H18(l)==C10H12(l)+3H2(g) ΔH1 Ⅱ C10H12(l)==C10H8(l)+2H2(g) ΔH2
假设某温度下, ΔH1>ΔH2>0。在下图中绘制下列“C10H18→C10H12→C10H8”的“能量~反应过程” 示意图正确的是: ( )
A. 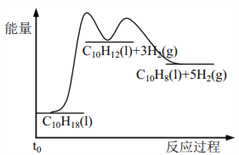 B.
B. 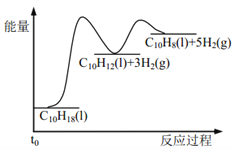
C. 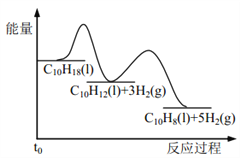 D.
D. 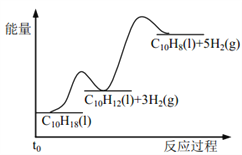
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有碘元素。某实验小组设计了如下实验流程,通过实验证明海带中存在碘元素,并从海带中提取出碘单质。

根据实验流程回答下列各题:
(1)步骤①中灼烧所用到硅酸盐材质的仪器,除酒精灯外还有______。
(2)步骤③的操作名称为______。
(3)经过步骤③以后,所得滤液中主要含有可溶性的无机盐:氯化钠、硫酸钠、碘化钠等。为了将I-变为碘单质,可加入经硫酸酸化的双氧水氧化,写出该反应的离子方程式______。检验步骤④是否成功的方法是______。
(4)步骤⑤操作名称是______。
(5)为了进一步制得纯净的碘单质,可以通过步骤⑥实现,实验装置如下图所示。

已知实验中得到的粗碘为碘的CCl4溶液,CCl4的沸点76.8℃、I2的沸点184.4℃。
①指出图中错误的地方并改正______。
②锥形瓶中先收集到的物质是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于离子键、共价键的下列说法中正确的是( )
A.CaCl2中既有离子键又有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D.由多种元素组成的多原子分子里,一定只存在极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的HA和HB分别与0.10 mol·L-1的NaOH溶液等体积混合,记录数据如下表,下列说法中正确的是
混合后的溶液 | 加入的酸 | 酸的浓度/(mol·L-1) | 混合后溶液的pH |
① | HA | 0.10 | 8.7 |
② | HB | 0.12 | 2 |
A. HA是强酸,HB是弱酸
B. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+)
C. 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1
D. 升高温度,溶液②中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光合作用得地球碳、氧循环的更要媒介。下图是利用模拟光合作用过程,将CO2和H2O转化为糖类同时释放O2的装置。下列说法正确的是
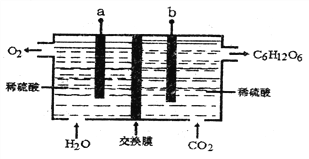
A. 该装置为原电池,其中a是原电池的正极
B. 该交换膜为阳离子交换膜,H+交换膜由左向右移动
C. 不考虑其它能量损耗,当外电路通过1mole-时生成15g葡萄糖
D. b极发生的电极反应:6CO2+24e-+18H2O=C6H12O6+24OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com